题目内容
2. KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:①所用KMnO4酸性溶液的浓度可选择:0.02mol•L-1、0.002mol•L-1;
②所用H2C2O4溶液的浓度可选择:0.2mol•L-1、0.4mol•L-1;
③每次实验时KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL.
(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成4组实验进行对比即可得出结论.
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如表所示:
| KMnO4酸性溶液浓度(mol•L-1) | 溶液褪色所需时间(min) | ||
| 第一次 | 第二次 | 第三次 | |
| 0.02 | 14 | 13 | 11 |
| 0.002 | 6.7 | 6.6 | 6.7 |
②该小组同学认为依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论.该同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论.
| KMnO4酸性溶液 | H2C2O4溶液 | ||
| 浓度/mol•L-1 | 体积(mL) | 浓度/mol•L-1 | 体积(mL) |
| 0.02 | 2 | b | 4 |
| a | 2 | c | 4 |
(3)H2C2O4电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5.与KMnO4反应时,它将转化为CO2和H2O.
①草酸与酸性高锰酸钾溶液反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
②比较H2C2O4和碳酸酸性强弱的方法是向碳酸氢钠溶液中加入草酸溶液,有气泡生成则证明草酸酸性强,反之碳酸强.
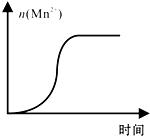
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图.请解释n(Mn2+)在反应初始时变化不大、一段时间后快速增大的原因:Mn2+对该反应起催化作用.
分析 (1)所做的实验至少有对比实验、改变浓度的实验、改变温度的实验、加催化剂的实验;
(2)①根据v=$\frac{△c}{△t}$计算;
②比较溶液的褪色时间,高锰酸钾酸性溶液的浓度应一致,H2C2O4溶液的浓度应不同;
(3)①在酸性条件下,高锰酸根离子能和草酸发生氧化还原反应生成二价锰离子、二氧化碳和水,据此写出离子方程式;
②根据强制弱原理设计实验证明酸性的强弱;
(4)根据浓度、温度、催化剂对化学反应速率的影响分析.
解答 解:(1)要得出反应物浓度、温度、催化剂对反应速率影响的结论至少要完成:①取不同浓度KMnO4溶液,在相同温度下进行反应;②取同浓度KMnO4溶液,在不同温度下进行反应;③取同浓度KMnO4溶溶,在同温度且有催化剂的条件下进行反应;④取同浓度KMnO4溶液,在同温度且不使用催化剂的条件下进行反应等3个实验来进行对比,
故答案为:4;
(2)①反应开始时:c(KMnO4)=$\frac{0.002mol•{L}^{-1}×0.004L}{0.004L+0.002L}$=0.0013 mol•L-1,反应时间:△t=$\frac{6.7+6.6+6.7}{3}$min=$\frac{20}{3}$min,
KMnO4的平均反应速率:ν(KMnO4)=$\frac{△c}{△t}$=$\frac{0.0013mol•{L}^{-1}}{\frac{20}{3}min}$=2×10-4 mol•L-1•min-1,
故答案为:2×10-4 mol•L-1•min-1;
②比较溶液的褪色时间,高锰酸钾酸性溶液的浓度应一致,因此a=0.02,H2C2O4溶液的浓度应不同,所用H2C2O4溶液的浓度可选择:0.2mol•L-1、0.4mol•L-1,因此b=0.2或0.4、c=0.4或0.2,
故答案为:0.02;0.2或0.4;0.4或0.2;
(3)①在酸性条件下,高锰酸根离子能和草酸发生氧化还原反应生成二价锰离子、二氧化碳和水,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
②根据强制弱原理来证明酸性的强弱,向碳酸氢钠溶液中加入草酸溶液,有气泡生成说明草酸与碳酸氢钠反应得到碳酸,碳酸不稳定分解产生二氧化碳,则证明草酸酸性强,若没明显现象则说明碳酸强,
故答案为:向碳酸氢钠溶液中加入草酸溶液,有气泡生成则证明草酸酸性强,反之碳酸强;
(4)随着反应的进行,反应物浓度逐渐减小,化学反应速率减慢,因此不是浓度,温度不变对速率无影响,催化剂可以加快化学反应速率,应为Mn2+对该反应起催化作用,
故答案为:Mn2+对该反应起催化作用.
点评 本题考查了外界条件的改变对化学反应速率的影响,题目难度较大,涉及对照试验以及化学反应速率的计算、酸性强弱的比较等知识,注意文字阐述的准确性.

 阅读快车系列答案
阅读快车系列答案| A. | 0.1 mol•L-1盐酸的澄清透明溶液:Fe3+、Na+、SO42-、Br- | |
| B. | pH=1的溶液中:Na+、K+、MnO4-、HCO3- | |
| C. | 能使石蕊变红的溶液:Cu2+、Na+、AlO2-、Cl- | |
| D. | c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、Cl- |
| A. | 滴定前,未用NaOH溶液对锥形瓶进行润洗 | |
| B. | 滴定过程中,有少量盐酸滴在锥形瓶外 | |
| C. | 盛装盐酸前,未对酸式滴定管进行润洗 | |
| D. | 滴定终点时,对酸式滴定管俯视读数 |
已知:
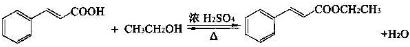
| 名称 | 相对分子质量 | 原色,状态 | 沸点(℃) | 密度(g•cm-3) |
| 肉桂酸 | 148 | 白色晶体 | 300 | 1.2475 |
| 肉桂酸乙酯 | 176 | 无色油状液体 | 271.5 | 1.0491 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
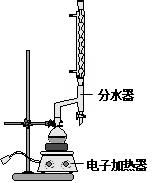
①在圆底烧瓶中加入14.80g肉桂酸,25mL95%的乙醇,20mL环己烷和4mL浓硫酸,混合均匀并加入沙粒,加热回流2h,至分水器中水层不再明显增加,停止加热,冷却至室温.
②将烧瓶内反应液倒入盛有适量水的烧杯中,加入Na2CO3,用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层,加入少量无水MgSO4固体,静置,过滤,对滤液进行蒸馏,低温蒸出乙醇、乙醚和环已烷后,继续升温,接收271~273℃的馏分.
③检验合格后,测得产品质量为13.60g.
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最合适的是C(填入正确选项前的字母)
A.25mL B.50mL C.100mL D.250mL
(2)步骤①中控制加热回流温度的范围A(填入正确选项前的字母)
A.65~70℃B.78.3~80.8℃C.80.8~271.5℃D.271.5~300℃
(3)步骤②中加入NaCO3的作用是除去过量的硫酸和肉桂酸,加入无水MgSO4固体的作用是除去产品中微量的水.
(4)关于该实验的操作叙述正确的是B.
A.冷凝管中的冷却水从上口进下口出,与管内蒸气形成逆流
B.使用分水器时,先加水接近支管口,随着加热回流,及时打开活塞放出少量的水
C.萃取操作时,振荡过程中需要放气,放气是通过打开分液漏斗上口的玻璃塞进行的
D.静置分层后,打开活塞,先放出有机层,再弃去水层
(5)检验产品中是否含有肉桂酸的方法取少量粗产品固体溶于水,测溶于的pH.
(6)计算肉桂酸乙酯的产率77.27%.
| A. | 位于周期表中同一周期的元素,原子具有相同的电子层数 | |
| B. | 凡是位于周期表中同一主族的元素,原子具有相同的最外层电子数 | |
| C. | 凡是位于周期表中同一周期的元素,都是按从左到右的顺序原子核外最外层电子数由1递增至8 | |
| D. | 凡是位于周期表中同一主族的元素,都是按从上到下的顺序原子核外电子层数逐渐递增 |
| A. | 加热后固体发黑 | B. | 坩埚沾有受热不分解的杂质 | ||
| C. | 加热时有少量晶体溅出 | D. | 晶体中混有受热不分解的杂质 |
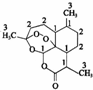 我国药学家屠呦呦教授因发现并提纯青蒿素而获得2015 年诺贝尔奖.青蒿素是用于治疗疟疾的药物,其结构简式如图:下列有关青蒿素的叙述正确的是( )
我国药学家屠呦呦教授因发现并提纯青蒿素而获得2015 年诺贝尔奖.青蒿素是用于治疗疟疾的药物,其结构简式如图:下列有关青蒿素的叙述正确的是( )| A. | 分子式为 C15H2205 | B. | 有较强的还原性,能杀死疟原虫 | ||
| C. | 易溶于水、酒精等溶剂 | D. | 能发生取代反应和加成反应 |
| A. | 复分解反应 | B. | 离子反应 | C. | 置换反应 | D. | 蒸发结晶 |