题目内容
13.实验室用已知浓度的盐酸滴定未知浓度的NaOH溶液,下列操作会使所测NaOH浓度偏低的是( )| A. | 滴定前,未用NaOH溶液对锥形瓶进行润洗 | |
| B. | 滴定过程中,有少量盐酸滴在锥形瓶外 | |
| C. | 盛装盐酸前,未对酸式滴定管进行润洗 | |
| D. | 滴定终点时,对酸式滴定管俯视读数 |
分析 根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:A.滴定前,未用NaOH溶液对锥形瓶进行润洗,标准液的体积不变,结果不变,故A错误;
B.滴定过程中,有少量盐酸滴在锥形瓶外,造成V(标准)偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,故B错误;
C.盛装盐酸前,未对酸式滴定管进行润洗,标准液浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,故C错误;
D.滴定终点时,对酸式滴定管俯视读数,造成V(标准)偏小,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏小,故D正确;
故选D.
点评 本题主要考查了中和滴定操作的误差分析,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析是解答的关键,题目难度不大.

练习册系列答案
相关题目
1.进行中和滴定实验使用的下列仪器,用蒸馏水洗涤后立即使用,不会引起实验误差的是( )
| A. | 酸式滴定管 | B. | 锥形瓶 | C. | 碱式滴定管 | D. | 以上均不正确 |
8.实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏高的是( )
| A. | 酸式滴定管在装酸液前用标准盐酸溶液润洗2~3次 | |
| B. | 开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 | |
| C. | 酸式滴定管读数时,滴定前正确读数,滴定后俯视读数 | |
| D. | 盛NaOH溶液的锥形瓶滴定前未干燥,带有水珠 |
2. KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.02mol•L-1、0.002mol•L-1;
②所用H2C2O4溶液的浓度可选择:0.2mol•L-1、0.4mol•L-1;
③每次实验时KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL.
(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成4组实验进行对比即可得出结论.
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如表所示:
①用0.002mol•L-1 KMnO4酸性溶液进行实验时,KMnO4的平均反应速率2×10-4mol•L-1•min-1(忽略混合前后溶液体积变化).
②该小组同学认为依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论.该同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论.
则表中a=0.02;b=0.2或0.4;c=0.4或0.2.
(3)H2C2O4电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5.与KMnO4反应时,它将转化为CO2和H2O.
①草酸与酸性高锰酸钾溶液反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
②比较H2C2O4和碳酸酸性强弱的方法是向碳酸氢钠溶液中加入草酸溶液,有气泡生成则证明草酸酸性强,反之碳酸强.
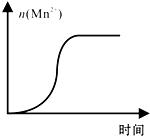
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图.请解释n(Mn2+)在反应初始时变化不大、一段时间后快速增大的原因:Mn2+对该反应起催化作用.
 KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:①所用KMnO4酸性溶液的浓度可选择:0.02mol•L-1、0.002mol•L-1;
②所用H2C2O4溶液的浓度可选择:0.2mol•L-1、0.4mol•L-1;
③每次实验时KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL.
(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成4组实验进行对比即可得出结论.
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如表所示:
| KMnO4酸性溶液浓度(mol•L-1) | 溶液褪色所需时间(min) | ||
| 第一次 | 第二次 | 第三次 | |
| 0.02 | 14 | 13 | 11 |
| 0.002 | 6.7 | 6.6 | 6.7 |
②该小组同学认为依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论.该同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论.
| KMnO4酸性溶液 | H2C2O4溶液 | ||
| 浓度/mol•L-1 | 体积(mL) | 浓度/mol•L-1 | 体积(mL) |
| 0.02 | 2 | b | 4 |
| a | 2 | c | 4 |
(3)H2C2O4电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5.与KMnO4反应时,它将转化为CO2和H2O.
①草酸与酸性高锰酸钾溶液反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
②比较H2C2O4和碳酸酸性强弱的方法是向碳酸氢钠溶液中加入草酸溶液,有气泡生成则证明草酸酸性强,反之碳酸强.
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图.请解释n(Mn2+)在反应初始时变化不大、一段时间后快速增大的原因:Mn2+对该反应起催化作用.
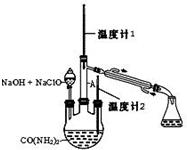 水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:
水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应: