题目内容
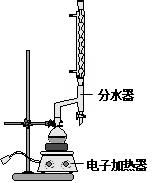
17.反应时环己烷-乙醇-水会形成“共沸物”(沸点62.6℃)蒸馏出来.在反应过程中,通过分水器下部的旋塞分出生成的水肉桂酸乙酯是一种常用的食用香精.实验室制备肉桂酸乙酯的反应.有关数据和装置示意图如下:已知:
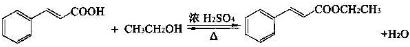
| 名称 | 相对分子质量 | 原色,状态 | 沸点(℃) | 密度(g•cm-3) |
| 肉桂酸 | 148 | 白色晶体 | 300 | 1.2475 |
| 肉桂酸乙酯 | 176 | 无色油状液体 | 271.5 | 1.0491 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
①在圆底烧瓶中加入14.80g肉桂酸,25mL95%的乙醇,20mL环己烷和4mL浓硫酸,混合均匀并加入沙粒,加热回流2h,至分水器中水层不再明显增加,停止加热,冷却至室温.
②将烧瓶内反应液倒入盛有适量水的烧杯中,加入Na2CO3,用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层,加入少量无水MgSO4固体,静置,过滤,对滤液进行蒸馏,低温蒸出乙醇、乙醚和环已烷后,继续升温,接收271~273℃的馏分.
③检验合格后,测得产品质量为13.60g.
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最合适的是C(填入正确选项前的字母)
A.25mL B.50mL C.100mL D.250mL
(2)步骤①中控制加热回流温度的范围A(填入正确选项前的字母)
A.65~70℃B.78.3~80.8℃C.80.8~271.5℃D.271.5~300℃
(3)步骤②中加入NaCO3的作用是除去过量的硫酸和肉桂酸,加入无水MgSO4固体的作用是除去产品中微量的水.
(4)关于该实验的操作叙述正确的是B.
A.冷凝管中的冷却水从上口进下口出,与管内蒸气形成逆流
B.使用分水器时,先加水接近支管口,随着加热回流,及时打开活塞放出少量的水
C.萃取操作时,振荡过程中需要放气,放气是通过打开分液漏斗上口的玻璃塞进行的
D.静置分层后,打开活塞,先放出有机层,再弃去水层
(5)检验产品中是否含有肉桂酸的方法取少量粗产品固体溶于水,测溶于的pH.
(6)计算肉桂酸乙酯的产率77.27%.
分析 (1)烧瓶中液体的体积不超过烧瓶容积的$\frac{2}{3}$;
(2)乙醇为反应物,该操作目的是回流乙醇;
(3)酸能和碳酸钠反应生成可溶性的钠盐;硫酸镁具有吸水性;
(4)A.冷凝管中的冷却水采用逆流的方法;
B.反应时环己烷-乙醇-水会形成“共沸物”(沸点62.6℃)蒸馏出来.在反应过程中,通过分水器下部的旋塞分出生成的水;
C.放气是通过打开分液漏斗的活塞进行;
D.静置分层后,打开活塞,水层后放有机层;
(5)肉桂酸中含有含有羧基,易溶于水,其水溶液呈酸性;
(6)实验的产率=$\frac{实际产量}{理论产量}$×100%.
解答 解:(1)烧瓶中液体的体积不超过烧瓶容积的$\frac{2}{3}$,混合液体的体积接近(25+20+4)mL=49mL,所以烧瓶的体积为100mL,故选C;
(2)乙醇为反应物,该操作目的是回流乙醇,增大产量,所以其温度应该低于乙醇温度,
故选A;
(3)硫酸和肉桂酸和碳酸钠反应生成钠盐,从而增大物质熔点差异性;硫酸镁具有吸水性,能除去产品中微量的水,
故答案为:除去过量的硫酸和肉桂酸;除去产品中微量的水;
(4)A.冷凝管中的冷却水采用逆流的方法,所以下口为进水口、上口为出水口,故A错误;
B.反应时环己烷-乙醇-水会形成“共沸物”(沸点62.6℃)蒸馏出来.在反应过程中,通过分水器下部的旋塞分出生成的水,故B正确;
C.放气是通过打开分液漏斗的活塞进行,其操作方法为右手顶住瓶塞,将漏斗倒置过来.以左手控制活栓,将活栓打开先放气一次,故C错误;
D.静置分层后,打开活塞,水密度大于有机层,水层在下方,所以应该下放水层后放有机层,故D错误;
故选B;
(5)肉桂酸中含有含有羧基,易溶于水,其水溶液呈酸性,所以可以将产品溶于水,然后测定溶于的pH,故答案为:取少量粗产品固体溶于水,测溶于的pH;
(6)m(乙醇)=0.7893g/mL×25mL×95%=18.75g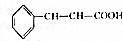 +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$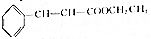 +H2O
+H2O
148g 46g
14.8g 18.75g
根据方程式知,如果148g肉桂酸反应需要46g乙醇,如果14.8g肉桂酸反应需要4.6g乙醇,所以乙醇过量,
设生成肉桂酸乙酯的质量为x,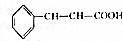 +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$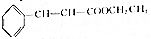 +H2O
+H2O
148g 176g
14.8g x
148g:17g6=14.8g:x,
x=17.6g
其产率=$\frac{13.60g}{17.6g}$×100%=77.27%,
故答案为:77.27%.
点评 本题考查物质制备实验方案设计,为高频考点,涉及基本操作、物质性质、仪器选取、方程式的计算等知识点,明确实验原理、物质性质是解本题关键,题目难度中等.

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案| 元素编号 | 元素特征信息 |
| A | 是原子半径最小的元素 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 是短周期元素中原子半径最大的主族元素. |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
| F | 原子有三个电子层,且最外层电子数是最内层电子数的3倍, |
(2)写出C与B 形成的两种离子化合物的化学式Na2O;Na2O2.
(3)写出B与A 形成的两种化合物的电子式
 ;
;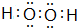 .
.(4)含B、C、F 三种元素的化合物有Na2SO4、Na2SO3(请填写具体的化学式,至少2种).
(5)D单质和C的最高价氧化物对应水化物水溶液反应的离子方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑.
(6)FB2和E元素的单质在水溶液中反应的化学方程式是SO2+Cl2+2H2O=2HCl+H2SO4.
(7)D的单质和氧化铁反应可用于野外焊接钢轨,该反应属于放热 (填“吸热”或“放热”)反应,写出反应的化学方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
| A. | 酸式滴定管在装酸液前用标准盐酸溶液润洗2~3次 | |
| B. | 开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 | |
| C. | 酸式滴定管读数时,滴定前正确读数,滴定后俯视读数 | |
| D. | 盛NaOH溶液的锥形瓶滴定前未干燥,带有水珠 |
用中和滴定法测定某烧碱样品的纯度.有以下步骤:
Ⅰ、配制待测液:用托盘天平称量5.00g烧碱样品(杂质不与盐酸反应),配成1000mL溶液;
Ⅱ、滴定:取20.00mL所配待测液,用0.1mol.L-1的盐酸标准溶液进行滴定,达到滴定终点后,重复此操作两次;
Ⅲ、记录数据如下表:
| 测定序号 | 待测溶液体积 (mL) | 所耗盐酸标准溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.2 | 21.32 |
| 3 | 20.00 | 1.3 | 21.50 |
(1)配制待测液时,除烧杯、玻璃杯、胶头滴管外,还需要的主要玻璃仪器有1000mL容量瓶
(2)盛装0.1mol.L-1的盐酸标准溶液应该使用酸式滴定管,滴定时眼睛应注意观察:锥形瓶中溶液颜色的变
(3)滴定时如果用甲基橙做指示剂,达到滴定的标志是溶液由黄色变为橙色,且半分钟不变色
(4)下列操作会造成测定结果偏高的是B(填字母序号)
A.用蒸馏水冲洗锥形瓶;
B.在滴定过程中不慎将数滴酸液滴在锥形瓶外;
C.读数时,滴定前仰视,滴定后俯视.
(5)计算烧碱样品的纯度是80.8%.
 KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:①所用KMnO4酸性溶液的浓度可选择:0.02mol•L-1、0.002mol•L-1;
②所用H2C2O4溶液的浓度可选择:0.2mol•L-1、0.4mol•L-1;
③每次实验时KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL.
(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成4组实验进行对比即可得出结论.
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如表所示:
| KMnO4酸性溶液浓度(mol•L-1) | 溶液褪色所需时间(min) | ||
| 第一次 | 第二次 | 第三次 | |
| 0.02 | 14 | 13 | 11 |
| 0.002 | 6.7 | 6.6 | 6.7 |
②该小组同学认为依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论.该同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论.
| KMnO4酸性溶液 | H2C2O4溶液 | ||
| 浓度/mol•L-1 | 体积(mL) | 浓度/mol•L-1 | 体积(mL) |
| 0.02 | 2 | b | 4 |
| a | 2 | c | 4 |
(3)H2C2O4电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5.与KMnO4反应时,它将转化为CO2和H2O.
①草酸与酸性高锰酸钾溶液反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
②比较H2C2O4和碳酸酸性强弱的方法是向碳酸氢钠溶液中加入草酸溶液,有气泡生成则证明草酸酸性强,反之碳酸强.
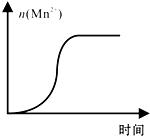
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图.请解释n(Mn2+)在反应初始时变化不大、一段时间后快速增大的原因:Mn2+对该反应起催化作用.
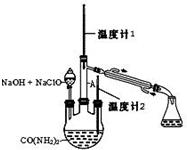 水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:
水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:

 ;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).
;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示). 分子式为CmH20的烷烃中m为9,分子中含有22个共价键的烷烃的分子式:C7H16,与CO2的密度(同温同压)相同的烷烃分子式为的C3H8.若上述四种烃各为1mol,在足量O2中燃烧,消耗O2最多的是(填分子式)C9H20.
分子式为CmH20的烷烃中m为9,分子中含有22个共价键的烷烃的分子式:C7H16,与CO2的密度(同温同压)相同的烷烃分子式为的C3H8.若上述四种烃各为1mol,在足量O2中燃烧,消耗O2最多的是(填分子式)C9H20.