题目内容
12.我国宋代《梦溪笔谈》中记叙了胆矾和铜的炼制过程:“信州铅山县有苦泉,煮之则得胆矾.熬胆矾铁釜,久之亦化为铜.”该炼制过程中没有涉及到的变化是( )| A. | 复分解反应 | B. | 离子反应 | C. | 置换反应 | D. | 蒸发结晶 |
分析 A、复分解反应是两种化合物相互交换成分生成另外两种化合物的反应;
B、有离子参加的反应为离子反应;
C、一种单质和一种化合物相互交换成分生成另一种单质和另一种化合物的反应为置换反应;
D、将溶液在蒸发皿等容器中加热,将溶剂蒸发得到溶质的过程.
解答 解:苦泉中含有溶质硫酸铜,“煮之则得胆矾”,涉及蒸发结晶,故D正确;“熬胆矾铁釜,久之亦化为铜”,是铁与硫酸铜发生置换反应,该反应也属于离子反应,故BC均正确;整个过程中未涉及复分解反应,故A错误.
故选A.
点评 本题以文言文的形式考查了化学反应和操作,难度不大,但是近几年常见的题型和高考的热点题型.

练习册系列答案
相关题目
2. KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.02mol•L-1、0.002mol•L-1;
②所用H2C2O4溶液的浓度可选择:0.2mol•L-1、0.4mol•L-1;
③每次实验时KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL.
(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成4组实验进行对比即可得出结论.
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如表所示:
①用0.002mol•L-1 KMnO4酸性溶液进行实验时,KMnO4的平均反应速率2×10-4mol•L-1•min-1(忽略混合前后溶液体积变化).
②该小组同学认为依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论.该同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论.
则表中a=0.02;b=0.2或0.4;c=0.4或0.2.
(3)H2C2O4电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5.与KMnO4反应时,它将转化为CO2和H2O.
①草酸与酸性高锰酸钾溶液反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
②比较H2C2O4和碳酸酸性强弱的方法是向碳酸氢钠溶液中加入草酸溶液,有气泡生成则证明草酸酸性强,反之碳酸强.
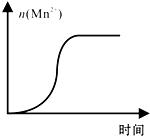
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图.请解释n(Mn2+)在反应初始时变化不大、一段时间后快速增大的原因:Mn2+对该反应起催化作用.
 KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:①所用KMnO4酸性溶液的浓度可选择:0.02mol•L-1、0.002mol•L-1;
②所用H2C2O4溶液的浓度可选择:0.2mol•L-1、0.4mol•L-1;
③每次实验时KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL.
(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成4组实验进行对比即可得出结论.
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如表所示:
| KMnO4酸性溶液浓度(mol•L-1) | 溶液褪色所需时间(min) | ||
| 第一次 | 第二次 | 第三次 | |
| 0.02 | 14 | 13 | 11 |
| 0.002 | 6.7 | 6.6 | 6.7 |
②该小组同学认为依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论.该同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论.
| KMnO4酸性溶液 | H2C2O4溶液 | ||
| 浓度/mol•L-1 | 体积(mL) | 浓度/mol•L-1 | 体积(mL) |
| 0.02 | 2 | b | 4 |
| a | 2 | c | 4 |
(3)H2C2O4电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5.与KMnO4反应时,它将转化为CO2和H2O.
①草酸与酸性高锰酸钾溶液反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
②比较H2C2O4和碳酸酸性强弱的方法是向碳酸氢钠溶液中加入草酸溶液,有气泡生成则证明草酸酸性强,反之碳酸强.
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图.请解释n(Mn2+)在反应初始时变化不大、一段时间后快速增大的原因:Mn2+对该反应起催化作用.
20.下列关于元素周期表的说法正确的是( )
| A. | 过渡元素全部都是副族元素 | |
| B. | 短周期共有32种元素 | |
| C. | 元素周期表共七个横行代表七个周期,18个纵行代表18个族 | |
| D. | 主族元素原子的最外层电子数等于该元素所属的族序数 |
1.已知:1molICl(s)被H2(g)完全还原为I2(s)和HCl(g)时,放出109kJ的热量,反应机理如下:
①H2+ICl→HI+HCl 慢反应
②HI+ICl→I2+HCl 快反应
下列说法正确的是( )
①H2+ICl→HI+HCl 慢反应
②HI+ICl→I2+HCl 快反应
下列说法正确的是( )
| A. | ICl中I显-1价 | |
| B. | HI是反应的中间产物 | |
| C. | 总反应速率的快慢主要由反应②决定 | |
| D. | 总反应的热化学方程式为H2(g)+2ICl(s)=I2(s)+2HCl(g)△H=-109kJ•mol-1 |
 分子式为CmH20的烷烃中m为9,分子中含有22个共价键的烷烃的分子式:C7H16,与CO2的密度(同温同压)相同的烷烃分子式为的C3H8.若上述四种烃各为1mol,在足量O2中燃烧,消耗O2最多的是(填分子式)C9H20.
分子式为CmH20的烷烃中m为9,分子中含有22个共价键的烷烃的分子式:C7H16,与CO2的密度(同温同压)相同的烷烃分子式为的C3H8.若上述四种烃各为1mol,在足量O2中燃烧,消耗O2最多的是(填分子式)C9H20.
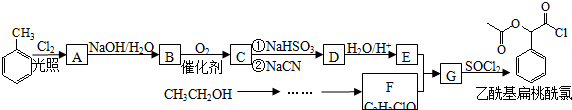
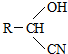 ,RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′
,RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′ .
. .
. .
.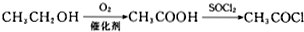 .
.