题目内容
14.在测定硫酸铜晶体结晶水含量的实验中,会导致测定结果偏低的是( )| A. | 加热后固体发黑 | B. | 坩埚沾有受热不分解的杂质 | ||
| C. | 加热时有少量晶体溅出 | D. | 晶体中混有受热不分解的杂质 |
分析 在硫酸铜晶体结晶水含量测定中,加热前后质量的减少量即是失去结晶水的质量,质量差偏大,使n值偏大,若质量差偏小,使n值偏小,据此进行解答.
解答 解:A.加热时间过长,部分变黑等都将导致硫酸铜分解固体变黑说明硫酸铜分解生成CuO与SO3,造成加热前后固体的质量差偏大,使测量结果偏高,故A错误;
B.坩锅内附有不分解的杂质,而加热前后固体的质量差不变,测量结果不变,故B错误;
C.加热过程中有少量晶体溅出,造成加热前后固体的质量差偏大,使测量结果偏高,故C错误;
D.晶体不纯,含有不挥发杂质,造成加热前后固体的质量差偏小,使测量结果偏低,故D正确;
故选D.
点评 本题考查硫酸铜晶体中结晶水的测定,题目难度不大,明确测定方法为解答关键,注意分析误差时从导致加热前后的质量差进行判断,试题培养了学生的化学实验能力.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
2. KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.02mol•L-1、0.002mol•L-1;
②所用H2C2O4溶液的浓度可选择:0.2mol•L-1、0.4mol•L-1;
③每次实验时KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL.
(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成4组实验进行对比即可得出结论.
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如表所示:
①用0.002mol•L-1 KMnO4酸性溶液进行实验时,KMnO4的平均反应速率2×10-4mol•L-1•min-1(忽略混合前后溶液体积变化).
②该小组同学认为依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论.该同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论.
则表中a=0.02;b=0.2或0.4;c=0.4或0.2.
(3)H2C2O4电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5.与KMnO4反应时,它将转化为CO2和H2O.
①草酸与酸性高锰酸钾溶液反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
②比较H2C2O4和碳酸酸性强弱的方法是向碳酸氢钠溶液中加入草酸溶液,有气泡生成则证明草酸酸性强,反之碳酸强.
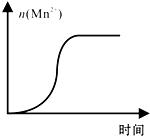
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图.请解释n(Mn2+)在反应初始时变化不大、一段时间后快速增大的原因:Mn2+对该反应起催化作用.
 KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:①所用KMnO4酸性溶液的浓度可选择:0.02mol•L-1、0.002mol•L-1;
②所用H2C2O4溶液的浓度可选择:0.2mol•L-1、0.4mol•L-1;
③每次实验时KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL.
(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成4组实验进行对比即可得出结论.
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如表所示:
| KMnO4酸性溶液浓度(mol•L-1) | 溶液褪色所需时间(min) | ||
| 第一次 | 第二次 | 第三次 | |
| 0.02 | 14 | 13 | 11 |
| 0.002 | 6.7 | 6.6 | 6.7 |
②该小组同学认为依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论.该同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论.
| KMnO4酸性溶液 | H2C2O4溶液 | ||
| 浓度/mol•L-1 | 体积(mL) | 浓度/mol•L-1 | 体积(mL) |
| 0.02 | 2 | b | 4 |
| a | 2 | c | 4 |
(3)H2C2O4电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5.与KMnO4反应时,它将转化为CO2和H2O.
①草酸与酸性高锰酸钾溶液反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
②比较H2C2O4和碳酸酸性强弱的方法是向碳酸氢钠溶液中加入草酸溶液,有气泡生成则证明草酸酸性强,反之碳酸强.
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图.请解释n(Mn2+)在反应初始时变化不大、一段时间后快速增大的原因:Mn2+对该反应起催化作用.
19.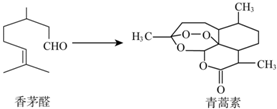 中国科学家屠呦呦因为创制了新型抗疟疾-青蒿素,获得2015年诺贝尔奖.青蒿素可由香茅醛为原料制取,下列说法错误的是( )
中国科学家屠呦呦因为创制了新型抗疟疾-青蒿素,获得2015年诺贝尔奖.青蒿素可由香茅醛为原料制取,下列说法错误的是( )
 中国科学家屠呦呦因为创制了新型抗疟疾-青蒿素,获得2015年诺贝尔奖.青蒿素可由香茅醛为原料制取,下列说法错误的是( )
中国科学家屠呦呦因为创制了新型抗疟疾-青蒿素,获得2015年诺贝尔奖.青蒿素可由香茅醛为原料制取,下列说法错误的是( )| A. | 香茅醛能使Br2的CCl4溶液褪色 | B. | 青蒿素分子式为C15H22O5 | ||
| C. | 青蒿素含有和H2O2相同的过氧键 | D. | 青蒿素能与氢气发生加成反应 |
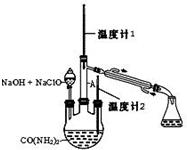 水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:
水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:

 ;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).
;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).