题目内容
下列离子方程式正确的是( )
| A、等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:2HCO3-+Ba2++2OH-=BaCO3↓+H2O+CO32- | ||||
| B、Na2S溶液吸收足量SO2:S2-+2SO2+2 H2O=2HSO3-+H2S↑ | ||||
| C、硫酸氢镁溶液中加入足量氢氧化钠:Mg2++2OHˉ=Mg(OH)2↓ | ||||
D、用铜为电极电解稀硫酸溶液:Cu+2H+
|
考点:离子方程式的书写
专题:离子反应专题
分析:A.等物质的量反应,生成碳酸钡、水、NaOH;
B.发生氧化还原反应生成S;
C.漏写氢离子与碱的反应;
D.阳极Cu失去电子,阴极氢离子得到电子生成氢气.
B.发生氧化还原反应生成S;
C.漏写氢离子与碱的反应;
D.阳极Cu失去电子,阴极氢离子得到电子生成氢气.
解答:
解:A.等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合的离子反应为HCO3-+Ba2++OH-=BaCO3↓+H2O,故A错误;
B.Na2S溶液吸收足量SO2的离子反应为2S2-+5SO2+2H2O=3S↓+4HSO3-,故B错误;
C.硫酸氢镁溶液中加入足量氢氧化钠的离子反应为2H++Mg2++4OH-=Mg(OH)2↓+2H2O,故C错误;
D.用铜为电极电解稀硫酸溶液的离子反应为Cu+2H+
Cu2++H2↑,故D正确;
故选D.
B.Na2S溶液吸收足量SO2的离子反应为2S2-+5SO2+2H2O=3S↓+4HSO3-,故B错误;
C.硫酸氢镁溶液中加入足量氢氧化钠的离子反应为2H++Mg2++4OH-=Mg(OH)2↓+2H2O,故C错误;
D.用铜为电极电解稀硫酸溶液的离子反应为Cu+2H+
| ||
故选D.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应、电解反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
某有机化合物的相对分子质量大于110,小于150,其中碳和氢的质量分数之和为52.24%,其余为氧,该化合物分子中最多可以含多少个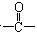 结构( )
结构( )
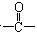 结构( )
结构( )| A、1个 |
| B、2 个 |
| C、3 个 |
| D、4个 |
NO2被水吸收的反应中,发生氧化反应的物质与发生还原反应的物质的质量比为( )
| A、1:2 | B、2:1 |
| C、1:3 | D、3:1 |
盛满NO2的试管倒置于水槽中,反应完毕后,液面上升的高度是试管的( )
A、
| ||
B、
| ||
C、
| ||
D、
|
 在杠杆的两端分别挂着质量、体积都相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在稀硫酸和硫酸铜溶液中片刻,如图所示,则下列说法正确的是( )
在杠杆的两端分别挂着质量、体积都相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在稀硫酸和硫酸铜溶液中片刻,如图所示,则下列说法正确的是( )| A、铝球一定是空心的 |
| B、左边烧杯中的溶液质量减少了 |
| C、去掉两烧杯杠杆仍平衡 |
| D、右边铁球上出现红色 |
已知热化学方程式:
2KNO3(s)=2KNO2(s)+O2(g)△H=+58kJ/mol
C(s)+O2(g)=CO2(g)△H=-94kJ/mol
为提供分解1mol KNO3所需的能量,理论上需完全燃烧碳( )
2KNO3(s)=2KNO2(s)+O2(g)△H=+58kJ/mol
C(s)+O2(g)=CO2(g)△H=-94kJ/mol
为提供分解1mol KNO3所需的能量,理论上需完全燃烧碳( )
A、
| ||
B、
| ||
C、
| ||
D、
|
将NH4HCO3置于干的试管中加热,并使放出的气体依次通过盛有过氧化钠和碱石灰的干燥管,最后得到的气体有( )
| A、NH3,O2 |
| B、H2O,O2 |
| C、CO2,O2 |
| D、O2 |
实验室制取少量干燥的氨气涉及下列装置,其中正确的是( )
A、 氨气发生装置 |
B、 氨气吸收装置 |
C、 氨气发生装置 |
D、 氨气收集、检验装置 |