题目内容
实验室制取少量干燥的氨气涉及下列装置,其中正确的是( )
A、 氨气发生装置 |
B、 氨气吸收装置 |
C、 氨气发生装置 |
D、 氨气收集、检验装置 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.NH4Cl固体受热分解生成NH3和HCl,而当温度降低时,NH3和HCl又重新化合成固体NH4Cl;
B.氨气极易溶于水,装置中相当于导气管直接插入水;
C.CaO遇水生成Ca(OH)2,同时放出大量热量,有利于氨气的生成;
D.装置图中收集氨气易与空气对流收集不到纯净的气体.
B.氨气极易溶于水,装置中相当于导气管直接插入水;
C.CaO遇水生成Ca(OH)2,同时放出大量热量,有利于氨气的生成;
D.装置图中收集氨气易与空气对流收集不到纯净的气体.
解答:
解:A.NH4Cl固体受热分解生成NH3和HCl,而当温度降低时,NH3和HCl又重新化合成固体NH4Cl,气体进入干燥管的机会不多,故A错误;
B.常温下,1体积水能溶解700体积氨气,氨气极易溶于水,按照装置图水会发生倒吸,故B错误;
C.向CaO中滴加浓氨水,CaO遇水生成Ca(OH)2,同时放出大量热量,使浓氨水中的氨气逸出,故C正确;
D.装置中试管口处应塞一团棉花,氨气防止与空气对流,得不到纯净的氨气,故D错误;
故选C.
B.常温下,1体积水能溶解700体积氨气,氨气极易溶于水,按照装置图水会发生倒吸,故B错误;
C.向CaO中滴加浓氨水,CaO遇水生成Ca(OH)2,同时放出大量热量,使浓氨水中的氨气逸出,故C正确;
D.装置中试管口处应塞一团棉花,氨气防止与空气对流,得不到纯净的氨气,故D错误;
故选C.
点评:本题考查氨气的实验室制备,难度不大,本题注意把握氨气的性质、反应原理与反应装置的关系是解答关键,注意氨气极易溶于水的性质.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
下列事实不能用勒夏特列原理解释的是( )
| A、溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
| B、已知,N2(g)+3 H2(g)?2NH3(g)△H<0,为提高氨的产率,理论上应采取降低温度的措施 |
| C、反应CO(g)+NO2(g)?CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深 |
| D、对于2HI(g)?H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |
下列离子方程式正确的是( )
| A、等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:2HCO3-+Ba2++2OH-=BaCO3↓+H2O+CO32- | ||||
| B、Na2S溶液吸收足量SO2:S2-+2SO2+2 H2O=2HSO3-+H2S↑ | ||||
| C、硫酸氢镁溶液中加入足量氢氧化钠:Mg2++2OHˉ=Mg(OH)2↓ | ||||
D、用铜为电极电解稀硫酸溶液:Cu+2H+
|
下列说法中不正确的是( )
| A、按系统命名法:CH3CH2C(CH3)2CH(C2H5)CH3的正确名称是3,3,4-三甲基己烷 |
| B、所有的糖、油脂、蛋白质都能水解,但水解产物不同 |
C、1mol的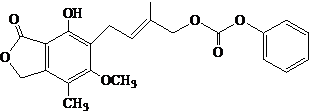 最多能与含5mol NaOH的水溶液完全反应 最多能与含5mol NaOH的水溶液完全反应 |
D、若完全燃烧,1mol雄酮( 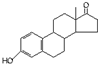 )比雌酮( )比雌酮(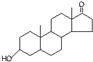 )多消耗3mol O2. )多消耗3mol O2. |
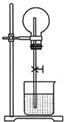 如图为中学化学教材上的喷泉实验装置.在烧瓶中充满了干燥气体,胶头滴管及烧瓶中分别盛有液体,下列各组中能形成这样喷泉但液体不能充满烧瓶的是( )
如图为中学化学教材上的喷泉实验装置.在烧瓶中充满了干燥气体,胶头滴管及烧瓶中分别盛有液体,下列各组中能形成这样喷泉但液体不能充满烧瓶的是( )| A、NH3 |
| B、NO2和H2O |
| C、CO2和NaOH溶液 |
| D、4:1的NO2与O2和水 |
可逆反应aA(g)+bB(g)?cC(g),改变温度(其他条件不变)、压强(其他条件不变)对上述反应正、逆反应速率的影响分别如图所示,以下叙述正确的是( )


| A、b>c,正反应为放热反应 |
| B、b<c,正反应为吸热反应 |
| C、a+b>c,正反应为放热反应 |
| D、a+b<c,正反应为吸热反应 |
下列说法中,正确的是( )
| A、22.4L的HCl含有6.02×1023个粒子 |
| B、32g氧气中含有2mol的氧原子 |
| C、氢氧化钠的摩尔质量为40g |
| D、如果有6.02×1023颗大米,则这些大米的物质的量为1mol |
上世纪80年代后期,人们发现NO在人体内起着多方面重要的生理作用.下列关于NO的说法错误的是( )
| A、NO是汽车尾气的有害成分之一 |
| B、NO是具有刺激性气味的红棕色气体 |
| C、NO极少量时在人体的血管系统内会促进血管扩张,防止血管栓塞 |
| D、NO能够与人体血红蛋白结合,吸入较多会造成人体缺氧中毒 |