题目内容
已知热化学方程式:
2KNO3(s)=2KNO2(s)+O2(g)△H=+58kJ/mol
C(s)+O2(g)=CO2(g)△H=-94kJ/mol
为提供分解1mol KNO3所需的能量,理论上需完全燃烧碳( )
2KNO3(s)=2KNO2(s)+O2(g)△H=+58kJ/mol
C(s)+O2(g)=CO2(g)△H=-94kJ/mol
为提供分解1mol KNO3所需的能量,理论上需完全燃烧碳( )
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:分解1molKNO3所需要的能量依据热化学方程式计算得到需要的热量,根据碳燃烧放出的热量计算需要的碳物质的量.
解答:
解:依据反应2KNO3(s)═2KNO2(s)+O2(g)△H=+58kJ?mol-1,反应1molKNO3所需要吸收的热量=
;提供
热量需要碳燃烧放出,依据热化学方程式计算;C(s)+O2(g)═CO2(g)△H=-94kJ?mol-1,反应放热
需要燃烧碳的物质的量为
mol;
故选B.
| 58kJ |
| 2 |
| 58kJ |
| 2 |
| 58kJ |
| 2 |
| 58 |
| 94×2 |
故选B.
点评:本题考查了热化学方程式计算的分析应用,掌握基础顺利解决,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
硫酸是一种重要的化工产品,2SO2+O2?2SO3是生产过程中的重要反应.下列对于该反应的说法中正确的是( )
| A、只要选择适宜的条件,SO2和O2就能全部转化为SO3 |
| B、该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零 |
| C、如果反应前充入由18O原子组成的O2,反应达到平衡状态时,18O只存在于O2和SO3中 |
| D、在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
下列说法中,正确的是( )
| A、通常状况下,N2和H2、O2都能反应 |
| B、在实验室收集NO气体可用排气法 |
| C、一定条件下,白磷转变成红磷是物理变化 |
| D、NO2是造成光化学烟雾污染的主要因素 |
 如图进行实验,试管内装有12mL NO,然后间歇而缓慢地通入8mL O2.下面有关实验最终状态的描述正确的是( )
如图进行实验,试管内装有12mL NO,然后间歇而缓慢地通入8mL O2.下面有关实验最终状态的描述正确的是( )| A、试管内气体呈棕红色 |
| B、试管内气体为无色的NO |
| C、试管内气体为无色的O2 |
| D、试管内液面高度上升到试管底部 |
下列离子方程式正确的是( )
| A、等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:2HCO3-+Ba2++2OH-=BaCO3↓+H2O+CO32- | ||||
| B、Na2S溶液吸收足量SO2:S2-+2SO2+2 H2O=2HSO3-+H2S↑ | ||||
| C、硫酸氢镁溶液中加入足量氢氧化钠:Mg2++2OHˉ=Mg(OH)2↓ | ||||
D、用铜为电极电解稀硫酸溶液:Cu+2H+
|
已知298K时,N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol,在相同条件下向密闭容器中加入1molN2和3molH2,达到平衡时的反应热为△H1,向另一容积相同的密闭容器中通入0.95molN2、2.85molH2、0.1molNH3,达到平衡时的反应热为△H2,则下列关系正确的是( )
| A、△H1=△H2=-92.4 kJ/mol |
| B、-92.4 kJ/mol<△H1<△H2 |
| C、△H1<△H2<-92.4 kJ/mol |
| D、△H1=△H2<-92.4 kJ/mol |
下列说法中不正确的是( )
| A、按系统命名法:CH3CH2C(CH3)2CH(C2H5)CH3的正确名称是3,3,4-三甲基己烷 |
| B、所有的糖、油脂、蛋白质都能水解,但水解产物不同 |
C、1mol的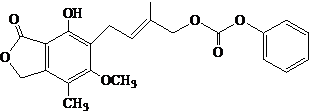 最多能与含5mol NaOH的水溶液完全反应 最多能与含5mol NaOH的水溶液完全反应 |
D、若完全燃烧,1mol雄酮( 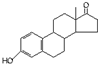 )比雌酮( )比雌酮(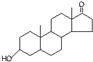 )多消耗3mol O2. )多消耗3mol O2. |
可逆反应aA(g)+bB(g)?cC(g),改变温度(其他条件不变)、压强(其他条件不变)对上述反应正、逆反应速率的影响分别如图所示,以下叙述正确的是( )


| A、b>c,正反应为放热反应 |
| B、b<c,正反应为吸热反应 |
| C、a+b>c,正反应为放热反应 |
| D、a+b<c,正反应为吸热反应 |
