题目内容
 在杠杆的两端分别挂着质量、体积都相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在稀硫酸和硫酸铜溶液中片刻,如图所示,则下列说法正确的是( )
在杠杆的两端分别挂着质量、体积都相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在稀硫酸和硫酸铜溶液中片刻,如图所示,则下列说法正确的是( )| A、铝球一定是空心的 |
| B、左边烧杯中的溶液质量减少了 |
| C、去掉两烧杯杠杆仍平衡 |
| D、右边铁球上出现红色 |
考点:铝的化学性质,铁的化学性质
专题:元素及其化合物
分析:开始杠杆平衡,分别浸没在稀硫酸和硫酸铜溶液中片刻,分别发生2Al+6H+=2Al3++3H2↑、Fe+Cu2+=Fe2++Cu,结合反应的现象及质量关系分析.
解答:
解:A.Fe的密度大,由V=
可知,质量、体积都相同,则Fe为空心,故A错误;
B.左边烧杯中发生2Al+6H+=2Al3++3H2↑,参加反应的Al为54g生成6g氢气,则溶液质量增加48g,故B错误;
C.分别发生2Al+6H+=2Al3++3H2↑、Fe+Cu2+=Fe2++Cu,左烧杯中固体质量减少,又烧杯中固体质量增加,则去掉两烧杯杠杆不能平衡,故C错误;
D.由Fe+Cu2+=Fe2++Cu可知,生成红色的Cu,则右边铁球上出现红色,故D正确;
故选D.
| m |
| ρ |
B.左边烧杯中发生2Al+6H+=2Al3++3H2↑,参加反应的Al为54g生成6g氢气,则溶液质量增加48g,故B错误;
C.分别发生2Al+6H+=2Al3++3H2↑、Fe+Cu2+=Fe2++Cu,左烧杯中固体质量减少,又烧杯中固体质量增加,则去掉两烧杯杠杆不能平衡,故C错误;
D.由Fe+Cu2+=Fe2++Cu可知,生成红色的Cu,则右边铁球上出现红色,故D正确;
故选D.
点评:本题考查Al的化学性质及反应方程式的应用,为高频考点,把握发生的反应及质量变化为解答的关键,侧重分析与应用能力的考查,注意差量法分析应用,题目难度不大.

练习册系列答案
相关题目
氢氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-=2H2O和
O2+H2O+2e-=2OH-,则下列叙述正确的是( )
| 1 |
| 2 |
| A、通H2的一极是正极,通O2的一极是负极 |
| B、通O2的一极是正极,通H2的一极是负极 |
| C、产物为无污染的水,属于环境友好电池 |
| D、燃料电池的能量转化率可达100% |
下列微粒:①H3O+②NH4+③CH3COO-④NH3⑤CH4中含有配位键的是( )
| A、①② | B、①③ | C、④⑤ | D、②④ |
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氢气中1mol H-H 键完全断裂时吸收热量436kJ,水蒸气中1mol H-O 键形成时放出热量463kJ,则氧气中1mol O=O 键断裂时吸收热量为( )
| A、188kJ |
| B、248 kJ |
| C、124kJ |
| D、496kJ |
如图装置或操作不能达到实验目的( )
A、 比较 Cl2、Fe3+、I2的氧化性 |
B、 制取Fe(OH)2 |
C、 证明铁生锈时空气参加反应 |
D、 检查装置的气密性 |
下列离子方程式正确的是( )
| A、等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:2HCO3-+Ba2++2OH-=BaCO3↓+H2O+CO32- | ||||
| B、Na2S溶液吸收足量SO2:S2-+2SO2+2 H2O=2HSO3-+H2S↑ | ||||
| C、硫酸氢镁溶液中加入足量氢氧化钠:Mg2++2OHˉ=Mg(OH)2↓ | ||||
D、用铜为电极电解稀硫酸溶液:Cu+2H+
|
在1L1mol/L的氨水中( )
| A、含有1molNH3 |
| B、含NH3和NH4+之和为1mol |
| C、含NH3?H2O1mol |
| D、含NH3、NH4+、NH3?H2O共1mol |
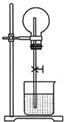 如图为中学化学教材上的喷泉实验装置.在烧瓶中充满了干燥气体,胶头滴管及烧瓶中分别盛有液体,下列各组中能形成这样喷泉但液体不能充满烧瓶的是( )
如图为中学化学教材上的喷泉实验装置.在烧瓶中充满了干燥气体,胶头滴管及烧瓶中分别盛有液体,下列各组中能形成这样喷泉但液体不能充满烧瓶的是( )| A、NH3 |
| B、NO2和H2O |
| C、CO2和NaOH溶液 |
| D、4:1的NO2与O2和水 |
生物学家借助新的显微技术,成功观察到小于20nm的微粒.下列分散系中分散质粒子直径最小的是 (1nm=1x10-9m)( )
| A、雾 |
| B、氢氧化铁胶体 |
| C、石灰乳 |
| D、KNO3溶液 |