题目内容
某有机化合物的相对分子质量大于110,小于150,其中碳和氢的质量分数之和为52.24%,其余为氧,该化合物分子中最多可以含多少个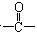 结构( )
结构( )
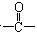 结构( )
结构( )| A、1个 |
| B、2 个 |
| C、3 个 |
| D、4个 |
考点:有机物实验式和分子式的确定,常见有机化合物的结构
专题:有机化学基础
分析:先根据含氧量和相对分子质量的范围,得出氧原子数,然后根据氧元素的质量分数求得有机化合物的相对分子质量,进而计算化学式,最后确定结构.
解答:
解:由题意知,O的质量分数为47.76%,由化合物A的相对分子质量大于110,小于150,
所以氧原子个数为大于
=3.28,小于
=4.48,所以氧原子为4个,
所以有机物分子质量=
=134,其中C、H的相对原子质量之和为134-16×4=70,一个亚甲基的相对分子质量是14,因此可确定分子式为C5H10O4.
C5H10O4与5个C原子的饱和衍生物(可表示为C5H12On)比较可知,分子中最多含有1个羰基官能团.
故选A.
所以氧原子个数为大于
| 110×0.4776 |
| 16 |
| 150×0.4776 |
| 16 |
所以有机物分子质量=
| 4×16 |
| 0.4776 |
C5H10O4与5个C原子的饱和衍生物(可表示为C5H12On)比较可知,分子中最多含有1个羰基官能团.
故选A.
点评:本题考查有机物分子式的确定,题目难度不大,注意计算氧原子数为解答该题的关键.

练习册系列答案
相关题目
分子式为C3H8O 的醇与分子式为C4H8O2的酸在浓硫酸存在时共热生成的酯有( )
| A、6种 | B、5种 | C、4种 | D、3种 |
下列排列顺序正确的是( )
①固体的热稳定性:CaCO3>Na2CO3>NaHCO3;
②还原性:SO32->I->Br-;
③微粒半径:K+>Na+>O2-;
④结合H+的能力:OH->AlO2->HCO3-;
⑤氢化物的沸点:H2O>NH3>HF.
①固体的热稳定性:CaCO3>Na2CO3>NaHCO3;
②还原性:SO32->I->Br-;
③微粒半径:K+>Na+>O2-;
④结合H+的能力:OH->AlO2->HCO3-;
⑤氢化物的沸点:H2O>NH3>HF.
| A、①③ | B、②④ | C、①② | D、③⑤ |
氢氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-=2H2O和
O2+H2O+2e-=2OH-,则下列叙述正确的是( )
| 1 |
| 2 |
| A、通H2的一极是正极,通O2的一极是负极 |
| B、通O2的一极是正极,通H2的一极是负极 |
| C、产物为无污染的水,属于环境友好电池 |
| D、燃料电池的能量转化率可达100% |
硫酸是一种重要的化工产品,2SO2+O2?2SO3是生产过程中的重要反应.下列对于该反应的说法中正确的是( )
| A、只要选择适宜的条件,SO2和O2就能全部转化为SO3 |
| B、该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零 |
| C、如果反应前充入由18O原子组成的O2,反应达到平衡状态时,18O只存在于O2和SO3中 |
| D、在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
下列物质能发生消去反应的是( )
① ②
② ③1丁醇 ④CHCl2CHBr2 ⑤2,2二甲基1丙醇 ⑥环己醇 ⑦(CH3)3CCH2Cl.
③1丁醇 ④CHCl2CHBr2 ⑤2,2二甲基1丙醇 ⑥环己醇 ⑦(CH3)3CCH2Cl.
①
 ②
② ③1丁醇 ④CHCl2CHBr2 ⑤2,2二甲基1丙醇 ⑥环己醇 ⑦(CH3)3CCH2Cl.
③1丁醇 ④CHCl2CHBr2 ⑤2,2二甲基1丙醇 ⑥环己醇 ⑦(CH3)3CCH2Cl.| A、①⑤ | B、②③④⑥⑦ |
| C、②③④⑥ | D、②③④ |
下列事实不能用勒夏特列原理解释的是( )
| A、溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
| B、已知,N2(g)+3 H2(g)?2NH3(g)△H<0,为提高氨的产率,理论上应采取降低温度的措施 |
| C、反应CO(g)+NO2(g)?CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深 |
| D、对于2HI(g)?H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |
下列离子方程式正确的是( )
| A、等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:2HCO3-+Ba2++2OH-=BaCO3↓+H2O+CO32- | ||||
| B、Na2S溶液吸收足量SO2:S2-+2SO2+2 H2O=2HSO3-+H2S↑ | ||||
| C、硫酸氢镁溶液中加入足量氢氧化钠:Mg2++2OHˉ=Mg(OH)2↓ | ||||
D、用铜为电极电解稀硫酸溶液:Cu+2H+
|