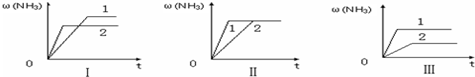
题目内容
9.下列实验现象描述正确的是( )| A. | 碘水中加入少量汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色 | |
| B. | 红热的铜丝在氯气中燃烧,产生了棕黄色的烟雾 | |
| C. | 卤素单质(X2)与水反应均可用X2+H2O=HX+HXO表示 | |
| D. | 溴化钠溶液中加入少量新制的氯水振荡,再加入少量四氯化碳振荡,静置后上层颜色变浅,下层颜色变为橙红色 |
分析 A.汽油的密度比水的密度小,分层后水在下层;
B.Cu与氯气反应生成固体氯化铜;
C.F2与水反应生成氧气;
D.氯气与NaBr发生氧化还原反应生成溴,溴易溶于四氯化碳,且四氯化碳的密度比水的密度大.
解答 解:A.汽油的密度比水的密度小,分层后水在下层,则静置后下层颜色变浅,上层颜色变为紫红色,故A错误;
B.Cu与氯气反应生成固体氯化铜,则产生了棕黄色的烟,故B错误;
C.F2与水反应生成氧气,表示为2X2+2H2O=4HX+O2,故C错误;
D.氯气与NaBr发生氧化还原反应生成溴,溴易溶于四氯化碳,且四氯化碳的密度比水的密度大,则静置后上层颜色变浅,下层颜色变为橙红色,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应与现象、萃取为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
相关题目
11. 当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因,煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一.
当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因,煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一.
(1)已知:H2O(g)=H2O(l)△H=44KJ/mol
①请写出煤的气化反应生成合成气(CO和H2)的热化学方程式H2O(g)+C(s)=CO(g)+H2(g)△H=+131.3kJ/mol.
②在恒温、恒容的反应器中,能表明上述反应达到平衡状态的是abef.
a.混合气体平均相对分子质量不再改变 b.气体压强不再改变
c.各气体浓度相等 d.反应体系中温度保持不变
e.断裂氢氧键速率是断裂氢氢键速率的2倍 f.混合提前密度不变
g.单位时间内,消耗水的质量与生成氢气的质量比为9:1
(2)甲醇是重要的化工原料,又可作为燃料,工业上利用合成气(主要成分为CO、CO2、H2)在催化剂的作用下合成甲醇,其中部分主要反应如下:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-58kJ/mol
①请推断该反应自发进行的条件为由于该反应△S<0,△H<0,故根据△G=△H-T△S<0,反应自发,可判断该反应在低温下能自发进行.
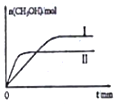
②若将1 mol CO2和2 mol H2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应,测得CH3OH的物质的量随时间的变化如图所示.曲线Ⅰ、Ⅱ对应的平成常数大小关系为KⅠ>KⅡ(填“>”或“=”或“<”);若5 min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为0.06mol/(L.min),该温度下的平衡常数为450;若容器容积不变,下列措施可增加甲醇产率的是d.
a.升高温度 b.使用合适的催化剂 c.充入He d.按原比例再充入CO2和H2
③CH4燃料电池利用率很高,装置中添加1L 2mol/L的KOH溶液为电解质,持续缓慢通入标准状况下甲烷2.24L时负极电极反应为CH4-8e-+10OH-=CO32-+7H2O.
 当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因,煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一.
当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因,煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一.(1)已知:H2O(g)=H2O(l)△H=44KJ/mol
| 物质 | H2(g) | C(s) | CO(g) |
| 燃烧热KJ/mol | 285.8 | 393.5 | 283.0 |
②在恒温、恒容的反应器中,能表明上述反应达到平衡状态的是abef.
a.混合气体平均相对分子质量不再改变 b.气体压强不再改变
c.各气体浓度相等 d.反应体系中温度保持不变
e.断裂氢氧键速率是断裂氢氢键速率的2倍 f.混合提前密度不变
g.单位时间内,消耗水的质量与生成氢气的质量比为9:1
(2)甲醇是重要的化工原料,又可作为燃料,工业上利用合成气(主要成分为CO、CO2、H2)在催化剂的作用下合成甲醇,其中部分主要反应如下:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-58kJ/mol
①请推断该反应自发进行的条件为由于该反应△S<0,△H<0,故根据△G=△H-T△S<0,反应自发,可判断该反应在低温下能自发进行.
②若将1 mol CO2和2 mol H2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应,测得CH3OH的物质的量随时间的变化如图所示.曲线Ⅰ、Ⅱ对应的平成常数大小关系为KⅠ>KⅡ(填“>”或“=”或“<”);若5 min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为0.06mol/(L.min),该温度下的平衡常数为450;若容器容积不变,下列措施可增加甲醇产率的是d.
a.升高温度 b.使用合适的催化剂 c.充入He d.按原比例再充入CO2和H2
③CH4燃料电池利用率很高,装置中添加1L 2mol/L的KOH溶液为电解质,持续缓慢通入标准状况下甲烷2.24L时负极电极反应为CH4-8e-+10OH-=CO32-+7H2O.
20.近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面,高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌于一体的新型高效多功能水处理剂.干燥的高铁酸钾受热易分解,但在198℃以下是稳定的.高铁酸钾在水处理过程中涉及的变化过程有( )
①胶体的吸附 ②盐类水解 ③焰色反应 ④氧化还原反应.
①胶体的吸附 ②盐类水解 ③焰色反应 ④氧化还原反应.
| A. | ①②③④ | B. | ①②④ | C. | ②③④ | D. | ①③④ |
17.在常温常压时,充分燃烧一定量的丁烷(C4H10)气体,放出热量QkJ(Q>0),将生成的二氧化碳全部通入足量NaOH溶液中,发生的反应为:CO2+2NaOH=Na2CO3+H2O,共消耗了4mol•L-1的NaOH溶液200mL.则此条件下,下列热化学方程式正确的是( )
| A. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=-QkJ•mol-1 | |
| B. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=-10QkJ•mol-1 | |
| C. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=+10QkJ•mol-1 | |
| D. | C4H10(g)+O2(g)═4CO2(g)+5H2O(g)△H=-10QkJ |
1.实验室有一包白色固体,可能含有硫酸铵、硫酸氢氨中的一种或两种,为确定其成分,现称取24.70g的白色固体溶于适量水中,然后滴加4mol•L-1的氢氧化钠溶液50.00mL,加热(此温度下铵盐不分解)充分反应使氨气全部逸出,测得氨气在标况下的体积为2.24L,则下列表述正确的是( )
| A. | 白色固体一定只含有硫酸铵 | |
| B. | 若氢氧化钠溶液足量,则生成氨气的体积应为6.72L(标况) | |
| C. | 从上述数据能求算出白色固体中(NH4)2SO4、NH4HSO4的物质的量之比为1:2 | |
| D. | 将某白色固体加热分解,若产生的气体不能使湿润的红色石蕊试纸变蓝,则该固体中一定不含铵盐 |
18.有关苯酚的下列叙述中,错误的是( )
| A. | 纯净的苯酚是粉红色的晶体,65℃以上时能与水互溶 | |
| B. | 苯酚是生产电木的单体之一,与甲醛发生缩聚反应 | |
| C. | 苯酚比苯更易发生苯环上的取代反应 | |
| D. | 苯酚有毒,也能配制洗涤剂和软药膏 |
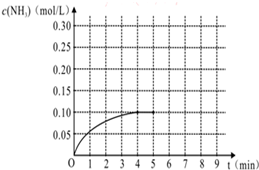 在一容积为4L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度变化情况如图:
在一容积为4L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度变化情况如图: