题目内容
17.在常温常压时,充分燃烧一定量的丁烷(C4H10)气体,放出热量QkJ(Q>0),将生成的二氧化碳全部通入足量NaOH溶液中,发生的反应为:CO2+2NaOH=Na2CO3+H2O,共消耗了4mol•L-1的NaOH溶液200mL.则此条件下,下列热化学方程式正确的是( )| A. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=-QkJ•mol-1 | |
| B. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=-10QkJ•mol-1 | |
| C. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=+10QkJ•mol-1 | |
| D. | C4H10(g)+O2(g)═4CO2(g)+5H2O(g)△H=-10QkJ |
分析 生成的二氧化碳全部通入足量NaOH溶液中,发生的反应为:CO2+2NaOH=Na2CO3+H2O,共消耗了4mol•L-1的NaOH溶液200mL,n(NaOH)=0.2L×4mol/L=0.8mol,即丁烷燃烧生成0.4molCO2时放出热量为Q,则生成10molCO2时放出热量为10Q,结合物质的状态、焓变书写热化学方程式,以此来解答.
解答 解:生成的二氧化碳全部通入足量NaOH溶液中,发生的反应为:CO2+2NaOH=Na2CO3+H2O,共消耗了4mol•L-1的NaOH溶液200mL,n(NaOH)=0.2L×4mol/L=0.8mol,即丁烷燃烧生成0.4molCO2时放出热量为Q,则生成10molCO2时放出热量为10Q,则丁烷燃烧的热化学方程式为C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=-10QkJ•mol-1,
故选B.
点评 本题考查热化学方程式,为高频考点,把握反应中能量变化、物质的量与热量的关系为解答的关键,侧重分析与应用能力的考查,注意判断燃烧生成的二氧化碳的物质的量,题目难度不大.

练习册系列答案
相关题目
8.已知:CuS、Cu2S是两种黑色不溶于水的固体,但一定条件下都能与稀HNO3反应,用离子方程式表示为:
①3CuS+8H++8NO3-=3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-=6Cu2++3SO42-+10NO↑+8H2O
现有不同质量的四份CuS、Cu2S的混合物样品分别和100mL物质的量浓度5mol/L稀硝酸充分反应,所取样品质量与产生气体体积(标准状况下测定)如表所示:
试回答下列问题(不考虑硝酸的挥发以及溶液体积变化):
(1)a组实验结束后,溶液中c(NO3-)=2.75mol/L;
(2)b组实验结束后,溶液的pH=0;
(3)通过计算分析实验c组中产生气体的体积(V)范围7L<V<11.2L.
①3CuS+8H++8NO3-=3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-=6Cu2++3SO42-+10NO↑+8H2O
现有不同质量的四份CuS、Cu2S的混合物样品分别和100mL物质的量浓度5mol/L稀硝酸充分反应,所取样品质量与产生气体体积(标准状况下测定)如表所示:
| 实验序号 | a | b | c |
| 样品质量(g) | 9.6 | 12.8 | 64.0 |
| 气体体积(L) | 5.04 | 6.72 | V |
(1)a组实验结束后,溶液中c(NO3-)=2.75mol/L;
(2)b组实验结束后,溶液的pH=0;
(3)通过计算分析实验c组中产生气体的体积(V)范围7L<V<11.2L.
5.下列表述错误的是( )
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | 碳酸钠水解的离子方程式:CO32-+2H2O?OH-+H2CO3 | |
| C. | CH3COOH的电离方程式为:CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 次氯酸的结构式:H-O-Cl |
12.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 取少量待检验溶液,向其中加入少量新制氯水,在滴加KSCN溶液,溶液呈血红色 | 待测液中含有Fe3+ |
| B | 室温下,向浓度均为0.1mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀. | Ksp(Ba2SO4)<Ksp(Ca2SO4) |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色 | Fe3+的氧化性比I2的强 |
| D | 室温下,用PH试纸测得:0.1mol•L-1 Na2SO3溶液的PH约为10;0.1mol•L-1 NaHSO3溶液的PH约为5 | HSO3-结合H+的能力比SO32-的强 |
| A. | A | B. | B | C. | C | D. | D |
2.下列说法正确的是( )
| A. | 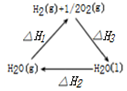 图表示:△H1=△H2+△H3 | |
| B. | 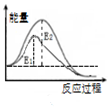 图表示:某反应在不用与用催化剂时,其反应活化能分别是E1和E2 | |
| C. | 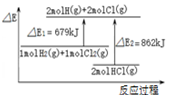 图表示:H2(g)+Cl2(g)=2HCl(g)△H=-183kJ/mol | |
| D. | 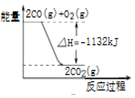 图表示:CO的燃烧热为1132KJ/mol |
9.下列实验现象描述正确的是( )
| A. | 碘水中加入少量汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色 | |
| B. | 红热的铜丝在氯气中燃烧,产生了棕黄色的烟雾 | |
| C. | 卤素单质(X2)与水反应均可用X2+H2O=HX+HXO表示 | |
| D. | 溴化钠溶液中加入少量新制的氯水振荡,再加入少量四氯化碳振荡,静置后上层颜色变浅,下层颜色变为橙红色 |
6.目前有四个实验方案,可行的是( )
| A. | 除去混在Cu粉中的少量Mg粉和Al粉,加稀盐酸后过滤 | |
| B. | 分离汽油和煤油,可用萃取的方法 | |
| C. | 分离硝酸钾和氯化钠固体的混合物,可用溶解、过滤的方法 | |
| D. | 将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气 |
7.化学与生活、社会发展息息相关.下列说怯不正确的是( )
| A. | 黑火药由硝石、硫磺、木炭按一定比例混合制成,其中“硝石”指的是硝酸钾 | |
| B. | “青篙一握,以水二升渍,绞取汁”,该挺取青蒿素的过程属于化学变化 | |
| C. | “丹砂(HgS)烧之成水银,积变又还成了丹砂”,该过程发生了分解、化合反应 | |
| D. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
 .若此烷烃的一氯代物分子中含有两个-CH3,两个-CH2-,一个
.若此烷烃的一氯代物分子中含有两个-CH3,两个-CH2-,一个 和一个-Cl,它的可能结构有四种,请写出它们的结构简式:CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3、CH3CH(CH3)CH2CH2Cl、CH2ClCH(CH3)CH2CH3.
和一个-Cl,它的可能结构有四种,请写出它们的结构简式:CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3、CH3CH(CH3)CH2CH2Cl、CH2ClCH(CH3)CH2CH3.