��Ŀ����
11��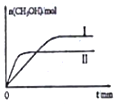 ��ǰ�����ɢ��ú��û������ú������й������������߶�����������Ҫԭ��ú�������ǽ����������������ú̿����Ҫ;��֮һ��
��ǰ�����ɢ��ú��û������ú������й������������߶�����������Ҫԭ��ú�������ǽ����������������ú̿����Ҫ;��֮һ����1����֪��H2O��g��=H2O��l����H=44KJ/mol
| ���� | H2��g�� | C��s�� | CO��g�� |
| ȼ����KJ/mol | 285.8 | 393.5 | 283.0 |
���ں��¡����ݵķ�Ӧ���У��ܱ���������Ӧ�ﵽƽ��״̬����abef��
a���������ƽ����Է����������ٸı� b������ѹǿ���ٸı�
c��������Ũ����� d����Ӧ��ϵ���¶ȱ��ֲ���
e�����������������Ƕ�����������ʵ�2�� f�������ǰ�ܶȲ���
g����λʱ���ڣ�����ˮ������������������������Ϊ9��1
��2���״�����Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϣ���ҵ�����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ����������ºϳɼ״������в�����Ҫ��Ӧ���£�
CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-58kJ/mol
�����ƶϸ÷�Ӧ�Է����е�����Ϊ���ڸ÷�Ӧ��S��0����H��0���ʸ��ݡ�G=��H-T��S��0����Ӧ�Է������жϸ÷�Ӧ�ڵ��������Է����У�
������1 mol CO2��2 mol H2�����ݻ�Ϊ2L�ĺ����ܱ������У������ֲ�ͬ�¶��·�����Ӧ�����CH3OH�����ʵ�����ʱ��ı仯��ͼ��ʾ�����ߢ��Ӧ��ƽ�ɳ�����С��ϵΪK����K�����������=������������5 min��Ӧ�ﵽƽ��״̬��H2��ת����Ϊ90%������CO2��ʾ��ƽ����Ӧ����Ϊ0.06mol/��L��min�������¶��µ�ƽ�ⳣ��Ϊ450���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���d��
a�������¶� b��ʹ�ú��ʵĴ��� c������He d����ԭ�����ٳ���CO2��H2
��CH4ȼ�ϵ�������ʺܸߣ�װ��������1L 2mol/L��KOH��ҺΪ����ʣ���������ͨ���״���¼���2.24Lʱ�����缫��ӦΪCH4-8e-+10OH-=CO32-+7H2O��
���� ��1�����ɱ����O2��g��+$\frac{1}{2}$H2��g��=H2O��l����H=-285.8kJ/mol ��
O2��g��+C��s��=CO2��g����H=-393.5kJ/mol ��
O2��g��+$\frac{1}{2}$CO��g��=CO2��g����H=-283.0kJ/mol ��
H2O��g��=H2O��l����H=44kJ/mol �ܣ���+��-��-�۵ã�ú��������Ӧ���ɺϳ�����CO��H2�����Ȼ�ѧ����ʽ
H2O��g��+C��s��=CO��g��+H2��g����H=+131.3kJ/mol���ݴ˽��з�����
�ڵ���Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��䣬�ɴ�������һЩ���������䣬ע���ҷ�Ӧ��һ����Ӧǰ�������������Ļ�ѧ��Ӧ�����Բ�����ѹǿ�ж�ƽ�⣻
��2���ٸ��ݡ�G=��H-T��S������G��0����Ӧ���Է����У�
��IIƽ��ʱ��С��I��˵��II��Ӧ���ʴ���I����ƽ��ʱII��CH3OH�����ʵ���С��I��˵��ƽ�����淴Ӧ�����ƶ�����ֻ���������¶ȣ��¶�Խ�ߣ���ѧƽ�ⳣ��ԽС����V=$\frac{��C}{��t}$��ƽ�ⳣ������ʽK=$\frac{c��C{H}_{3}OH����c��{H}_{2}O��}{c��C{O}_{2}����{c}^{3}��{H}_{2}��}$����ƽ������������з�����
��ȼ�ϵ���У�������ȼ��ʧ���ӷ���������Ӧ��
��� �⣺��1�����ɱ����O2��g��+$\frac{1}{2}$H2��g��=H2O��l����H=-285.8kJ/mol ��
O2��g��+C��s��=CO2��g����H=-393.5kJ/mol ��
O2��g��+$\frac{1}{2}$CO��g��=CO2��g����H=-283.0kJ/mol ��
H2O��g��=H2O��l����H=44kJ/mol �ܣ���+��-��-�۵ã�ú��������Ӧ���ɺϳ�����CO��H2�����Ȼ�ѧ����ʽ
H2O��g��+C��s��=CO��g��+H2��g����H=+131.3kJ/mol��
�ʴ�Ϊ��H2O��g��+C��s��=CO��g��+H2��g����H=+131.3kJ/mol��
��a���������ƽ����Է����������ٸı䣬���ڷ�Ӧ������������������ͬ����ѹǿʼ�仯�����Ի������ƽ����Է����������ٸı䣬���жϴ˷�Ӧ�ﵽƽ��״̬����a��ȷ��
b������ʱ�����ڷ�Ӧ������������������ͬ��ѹǿ���䣬���жϴ˷�Ӧ�ﵽƽ��״̬����b��ȷ��
c�����������Ũ����ȣ������жϸ���ֵ�Ũ�Ȳ��䣬��֤���ﵽ��ƽ��״̬����c����
d����Ӧ��ϵ���¶ȱ��ֲ��䣬����˵����Ӧ�ﵽ��ƽ��״̬����d����
e�����������������Ƕ�����������ʵ�2����˵�����淴Ӧ������ȣ��ﵽ��ƽ��״̬����e��ȷ��
f����������ܶȲ��䣬���ڷ�Ӧ������������������ͬ�������ܶȲ��䣬��Ũ�Ȳ��ٷ����仯������˵����Ӧ�ﵽƽ��״̬����f��ȷ��
g����λʱ���ڣ�����ˮ��������������������Ϊ9��1��ˮ�����������ʵ���֮��Ϊ1��1����ʾ�Ķ������淴Ӧ���ʣ����ж����淴Ӧ������ȣ���g����
�ʴ�Ϊ��abef��
��2�������ڸ÷�Ӧ��S��0����H��0���ʸ��ݡ�G=��H-T��S��0����Ӧ�Է������жϸ÷�Ӧ�ڵ��������Է����У��ʴ�Ϊ�����ڸ÷�Ӧ��S��0����H��0���ʸ��ݡ�G=��H-T��S��0����Ӧ�Է������жϸ÷�Ӧ�ڵ��������Է����У�
��IIƽ��ʱ��С��I��˵��II��Ӧ���ʴ���I����ƽ��ʱII��CH3OH�����ʵ���С��I��˵��ƽ�����淴Ӧ�����ƶ�����ֻ���������¶ȣ���II���¶ȴ���I���¶�Խ�ߣ�ƽ�����淴Ӧ�����ƶ������»�ѧƽ�ⳣ��ԽС������K����K����
CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼ��C�� 0.5 1 0 0
�仯 0.3 0.9 0.3 0.3
5min 0.2 0.1 0.3 0.3��V��CO2��=$\frac{��C}{��t}$=$\frac{0.3mol/L}{5miin}$=0.06mol/��L��min����ƽ�ⳣ������ʽK=$\frac{c��C{H}_{3}OH����c��{H}_{2}O��}{c��C{O}_{2}����{c}^{3}��{H}_{2}��}$=$\frac{0.3��0.3}{0.2��0��{1}^{3}}$=450��ƽ������������У��ʿ��еĴ�ʩ�а�ԭ�����ٳ���CO2��H2�������ӷ�Ӧ��Ũ�ȣ�ƽ������������У�
�ʴ�Ϊ������0.06mol/��L��min����450��d��
�ۼ���ȼ�ϵ���У������ϼ���ʧ���Ӻ����������ӷ�Ӧ����̼������Ӻ�ˮ���缫��ӦʽΪ��CH4-8e-+10OH-=CO32-+7H2O��
�ʴ�Ϊ��CH4-8e-+10OH-=CO32-+7H2O��
���� ���������ۺ�����Ŀ���ؼ��ǣ�2���ڿ����˻�ѧƽ�ⳣ������ѧƽ���ƶ�Ӱ�����أ��Լ�II��I�������߱仯ȷ���¶ȸߵͣ��Ӷ�ȷ����ѧƽ�ⳣ����Ϊ����ѵ㣮

 ��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�
��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�| A�� | ������ӵ����ģ��  | B�� | ȩ���ĵ���ʽ  | ||
| C�� | ����Ľṹ��ʽ C2H4O2 | D�� | ��ϩ�����ʽΪ CH2 |
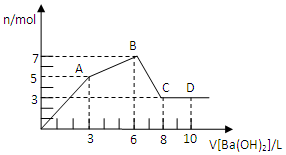 ��Al2��SO4��3��AlCl3�Ļ����Һ����μ���1mol/L Ba��OH��2��Һ������������Ba��OH��2��Һ����������ó��������Ĺ�ϵ��ͼ������˵������ȷ���ǣ�������
��Al2��SO4��3��AlCl3�Ļ����Һ����μ���1mol/L Ba��OH��2��Һ������������Ba��OH��2��Һ����������ó��������Ĺ�ϵ��ͼ������˵������ȷ���ǣ�������| A�� | ͼ��C����Ԫ�ش��ڵ���ʽ��[Al��OH��4]- | |
| B�� | ��D����Һ��ͨ�����CO2���壬����������ɫ���� | |
| C�� | ԭ�����Һ��c[Al2��SO4��3]��c��AlCl3��=1��2 | |
| D�� | OA�η�Ӧ�����ӷ���ʽΪ��2Al3++3SO42-+3Ba2++8OH-�T2Al��OH��4-+3BaSO4�� |
| ѡ�� | ʵ���������ʵ | ���� |
| A | ���������Һ��SO42-���ȵ���ϡ���ᣬ�ٵ���BaCl2��Һ | �ȵ���������ų�Ag+��CO3-��SO32-�����Ӹ��� |
| B | ��������ϡ������ | �������汻HNO3�����γ����ܵ�����Ĥ |
| C | ��Fe��NO3��2��Һ�м���ϡ���ᣬ�Թܿ��к���ɫ������� | ��Һ��NO3-��Fe2+��ԭΪNO2 |
| D | ��Mg��HCO3��2��Ӳˮ��ʱ���ּ��ȣ����յõ��ij��������Ҫ�ɷ�ΪMg��OH��2������MgCO3 | Kap��MgCO3����Kap[Mg��OH��2] |
| A�� | A | B�� | B | C�� | C | D�� | D |
| A�� | һ����ȩ������1��̼ԭ�ӡ�2����ԭ�ӡ�1����ԭ�ӹ��ɵ� | |
| B�� | ��ȩ��̼���⡢������Ԫ�ص�������Ϊ1��2��1 | |
| C�� | ��ȩ��̼���⡢������Ԫ����ɵ� | |
| D�� | ��ȩ����Ԫ�ص���������Ϊ53.3% |
��3CuS+8H++8NO3-=3Cu2++3SO42-+8NO��+4H2O
��3Cu2S+16H++10NO3-=6Cu2++3SO42-+10NO��+8H2O
���в�ͬ�������ķ�CuS��Cu2S�Ļ������Ʒ�ֱ��100mL���ʵ���Ũ��5mol/Lϡ�����ַ�Ӧ����ȡ��Ʒ��������������������״���²ⶨ�������ʾ��
| ʵ����� | a | b | c |
| ��Ʒ������g�� | 9.6 | 12.8 | 64.0 |
| ���������L�� | 5.04 | 6.72 | V |
��1��a��ʵ���������Һ��c��NO3-��=2.75mol/L��
��2��b��ʵ���������Һ��pH=0��
��3��ͨ���������ʵ��c���в�������������V����Χ7L��V��11.2L��
| A�� | ��ˮ�м����������������ú��ϲ���ɫ��dz���²���ɫ��Ϊ�Ϻ�ɫ | |
| B�� | ���ȵ�ͭ˿��������ȼ�գ��������ػ�ɫ������ | |
| C�� | ±�ص��ʣ�X2����ˮ��Ӧ������X2+H2O=HX+HXO��ʾ | |
| D�� | �廯����Һ�м����������Ƶ���ˮ���ټ����������Ȼ�̼�����ú��ϲ���ɫ��dz���²���ɫ��Ϊ�Ⱥ�ɫ |
 ������������һ�ȴ�������к�������-CH3������-CH2-��һ��
������������һ�ȴ�������к�������-CH3������-CH2-��һ��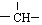 ��һ��-Cl�����Ŀ��ܽṹ�����֣���д�����ǵĽṹ��ʽ��CH3CH2CH2CHClCH3��CH3CH2CHClCH2CH3��CH3CH��CH3��CH2CH2Cl��CH2ClCH��CH3��CH2CH3��
��һ��-Cl�����Ŀ��ܽṹ�����֣���д�����ǵĽṹ��ʽ��CH3CH2CH2CHClCH3��CH3CH2CHClCH2CH3��CH3CH��CH3��CH2CH2Cl��CH2ClCH��CH3��CH2CH3��