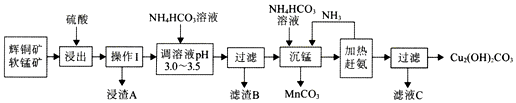
题目内容
14.(1)分别取0.1mol 钠、镁、铝与足量的盐酸反应,在相同条件下产生 H2的体积比是1:2:3(2)若产生相同物质的量的H2,所需钠、镁、铝的质量比为23:12:9.
(3)若产生相同体积(同温同压下)的H2,所需钠、镁、铝的物质的量比为6:3:2.
(4)若将0.2mol 钠、镁、铝分别投入到10mL lmol/L 的盐酸中,在标准状况下,产生H2体积的大小顺序是Na>Mg=Al.
分析 题中涉及到的化学方程式有①2Na+2HCl=2NaCl+H2↑,②Mg+2HCl=MgCl2+H2↑,③2Al+6HCl=2AlCl3+3H2↑,根据各反应物的物质的量结合化学方程式计算.
解答 解:(1)分别取0.1mol 钠、镁、铝与足量的盐酸反应,则:
2Na+2HCl=2NaCl+H2↑、Mg+2HCl=MgCl2+H2↑,2Al+6HCl=AlCl3+3H2↑,
0.1mol 0.05mol 0.1mol 0.1mol 0.1mol 0.15mol
故在相同条件下产生氢气的体积比=0.05mol:0.1mol:0.15mol=1:2:3,
故答案为:1:2:3;
(2)产生相同物质的量的氢气,设氢气为3mol,则:
2Na+2HCl=2NaCl+H2↑、Mg+2HCl=MgCl2+H2↑、2Al+6HCl=AlCl3+3H2↑,
6mol 3mol 3mol 3mol 2mol 3mol
故所需钠、镁、铝的物质的量之比=6mol:3mol:2mol=6:3:2,
则质量比=6×23:3×24::2×27=23:12:9,
故答案为:23:12:9;
(3)由反应方程式可知,若产生相同体积(同温同压下)的氢气,所需钠、镁、铝三种金属的物质的量之比为2mol:1mol:$\frac{2}{3}$mol=6:3:2,
故答案为:6:3:2;
(4)若将三种金属各0.2mol分别投入10mL1mol/L的盐酸中,可知三种金属都过量,但金属钠活泼,能与水反应生成氢气,则生成氢气最多的是钠,镁和铝生成氢气的体积一样多,故答案为:Na>Mg=Al.
点评 本题考查了金属与酸反应、化学方程式的相关计算,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意钠性质的特殊性,即过量钠和水反应产生氢气,在其它题目中易被忽略.

 备战中考寒假系列答案
备战中考寒假系列答案| 选项 | 实验现象或事实 | 解释 |
| A | 检验待测溶液中SO42-,先滴入稀盐酸,再滴入BaCl2溶液 | 先滴入盐酸可排除Ag+、CO3-、SO32-等离子干扰 |
| B | 铝箔插入稀硝酸中 | 铝箔表面被HNO3氧化形成致密的氧化膜 |
| C | 向Fe(NO3)2溶液中加入稀硫酸,试管口有红棕色气体产生 | 溶液中NO3-被Fe2+还原为NO2 |
| D | 含Mg(HCO3)2的硬水长时间充分加热,最终得到的沉淀物的主要成分为Mg(OH)2而不是MgCO3 | Kap(MgCO3)<Kap[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | 碳酸钠水解的离子方程式:CO32-+2H2O?OH-+H2CO3 | |
| C. | CH3COOH的电离方程式为:CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 次氯酸的结构式:H-O-Cl |
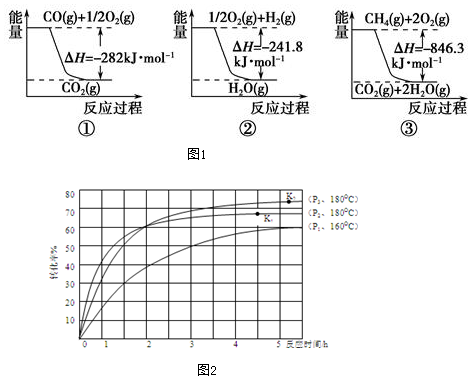
| A. | 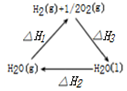 图表示:△H1=△H2+△H3 | |
| B. | 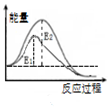 图表示:某反应在不用与用催化剂时,其反应活化能分别是E1和E2 | |
| C. | 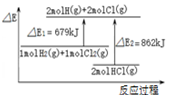 图表示:H2(g)+Cl2(g)=2HCl(g)△H=-183kJ/mol | |
| D. | 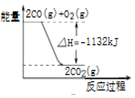 图表示:CO的燃烧热为1132KJ/mol |
| A. | 碘水中加入少量汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色 | |
| B. | 红热的铜丝在氯气中燃烧,产生了棕黄色的烟雾 | |
| C. | 卤素单质(X2)与水反应均可用X2+H2O=HX+HXO表示 | |
| D. | 溴化钠溶液中加入少量新制的氯水振荡,再加入少量四氯化碳振荡,静置后上层颜色变浅,下层颜色变为橙红色 |
第一步:配制饱和NaCl溶液,倒入烧杯中加热;
第一步:控制温度在30-35℃.边搅拌边分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟;
第三步:静置、过滤得NaHCO3晶体.用少量蒸馏水洗涤除去杂质,然后抽干;
第四步:将第二步所得固体转入蒸发皿中,灼烧2小时,制得纯碱固体,
已知:温度高于35℃时,NH4HCO3会分解.有关盐的溶解度(g/100g水)如表:
| 盐 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -- | -- | -- | -- |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.l | 12.7 | 14.5 | 16.4 | -- |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
(1)反应温度控制在30-35℃范围内,应采取的加热方法为水浴加热,反应温度不能高于35℃的理由是高于35℃时NH4HCO3会分解.
(2)第三步静置后析出NaHCO3晶体的原因是NaHCO3的溶解度最小;用蒸馏水洗涤NaHCO3晶体的目的是除去杂质粒子Cl-、NH4+(用离子符号表示).
(3)若向过滤所得母液中加入稀盐酸(填写试剂名称),并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl.
(4)纯碱产品不纯,含有NaHCO3、NaCl等杂质.测定纯碱中NaHCO3含量的方法是:准确称取纯碱样品Wg,放入锥形瓶中加蒸馏水溶解,加l-2滴酚酞指示剂,用物质的量浓度为cmol/L的盐酸滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点),所用盐酸体积为V1mL,再加1-2滴甲基橙指示剂,继续用盐酸滴定至溶液由黄变橙,所用盐酸总体积为V2mL.
①实验室配制一定体积cmol/L盐酸需用的仪器除了容量瓶、烧杯、量筒外还需胶头滴管、玻璃棒;在容量瓶的使用方法中,下列操作正确的是ae(填写标号)
a.使用容量瓶前检验它是否漏水
b.容量瓶用蒸馏水洗净后,再用待配溶液润洗
c.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中.然后加蒸馏水定容
d.用容量瓶把溶液配制完成以后.直接贴上标签,放置备用
e.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手指托住瓶底,把容量瓶倒转和摇动几次
②写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3 (%)=$\frac{c({V}_{2}-{V}_{1})×84}{1000w}$×100%.
| A. | 除去混在Cu粉中的少量Mg粉和Al粉,加稀盐酸后过滤 | |
| B. | 分离汽油和煤油,可用萃取的方法 | |
| C. | 分离硝酸钾和氯化钠固体的混合物,可用溶解、过滤的方法 | |
| D. | 将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气 |