题目内容
南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水.
(1)硬水是指含有较多 的水,硬水加热后产生沉淀的离子方程式为: ( 写出生成一种沉淀物的即可).
(2)硬度为1°的水是指每升水含10mg CaO或与之相当的物质(如7.1mg MgO),已知水的硬度在8°以下的软水,在8°以上的称为硬水.已知岛上山泉水中c( Ca2+)=1.2×10-3mol/L,c(Mg2+)=6×l0-4 mol/L,那么此水 (填“是”或“否”)属于硬水.
(3)离子交换法是软化水的常用方法.聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式 .
(4)解放军战士通常向水中加入明矾净水,请用离子方程式解释其净水原理: .
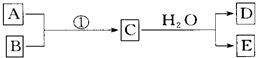
(5)岛上还可以用海水淡化来获得淡水.下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.请分析下列问题:

①阳离子交换膜是指 (填A或B).
②写出通电后阳极区的电极反应式 ,阴极区的现象是: .
(1)硬水是指含有较多
(2)硬度为1°的水是指每升水含10mg CaO或与之相当的物质(如7.1mg MgO),已知水的硬度在8°以下的软水,在8°以上的称为硬水.已知岛上山泉水中c( Ca2+)=1.2×10-3mol/L,c(Mg2+)=6×l0-4 mol/L,那么此水
(3)离子交换法是软化水的常用方法.聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式
(4)解放军战士通常向水中加入明矾净水,请用离子方程式解释其净水原理:
(5)岛上还可以用海水淡化来获得淡水.下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.请分析下列问题:

①阳离子交换膜是指
②写出通电后阳极区的电极反应式
考点:电解原理
专题:
分析:(1)硬水是含有较多可溶性钙盐、镁盐的水,硬水中的碳酸氢钙受热分解生成碳酸钙沉淀;
(2)依据硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO),将水中的Ca2+、Mg2+质量折算成CaO的质量计算得到;
(3)聚丙烯酸钠的单体为丙烯钠;
(4)铝离子水解生成氢氧化铝和氢离子,氢氧化铝具有吸附性能够吸附杂质颗粒,可以用来净水;
(5)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过;
②根据阳极是氯离子放电,阴极区是氢离子得到电子生成氢气,氢氧根离子浓度增大.
(2)依据硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO),将水中的Ca2+、Mg2+质量折算成CaO的质量计算得到;
(3)聚丙烯酸钠的单体为丙烯钠;
(4)铝离子水解生成氢氧化铝和氢离子,氢氧化铝具有吸附性能够吸附杂质颗粒,可以用来净水;
(5)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过;
②根据阳极是氯离子放电,阴极区是氢离子得到电子生成氢气,氢氧根离子浓度增大.
解答:
解:(1)硬水是含有较多可溶性钙盐、镁盐的水,硬水中的碳酸氢钙受热分解生成碳酸钙沉淀,方程式为:Ca2++2HCO3-
CaCO3↓+CO2↑+H2O;
故答案为:Ca2++2HCO3-
CaCO3↓+CO2↑+H2O;
(2)某天然水中c(Ca2+)=1.2×10-3mol?L-1,c(Mg2+)=6×10-4mol?L-1,硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO);1L水中钙离子物质的量=1.2×10-3mol,相当于CaO质量=1.2×10-3mol×56g/mol=67.2mg,1L水中镁离子物质的量=6×10-4mol,相当于氧化镁质量6×10-4mol×40g/mol=24mg,水的硬度=
+
=10°,属于硬水;
故答案为:是;
(3)聚丙烯酸钠的单体为丙烯钠,结构简式:CH2=CHCOONa,故答案为:CH2=CHCOONa;
(4)铝离子水解生成氢氧化铝和氢离子,离子方程式:Al3++3H2O Al(OH)3(胶体)+3H+,
Al(OH)3(胶体)+3H+,
故答案为:Al3++3H2O Al(OH)3(胶体)+3H+;
Al(OH)3(胶体)+3H+;
(5)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过,隔膜B和阴极相连,阴极是阳离子放电,所以隔膜B是阳离子交换膜,
故答案为:B;
②根据阳极是氯离子放电:2Cl--2e-═Cl2↑,阴极区是氢离子得到电子生成氢气,氢氧根离子浓度增大,和钙离子,镁离子形成沉淀,
故答案为:2Cl--2e-═Cl2↑;电极上产生气泡,溶液中出现少量白色沉淀.
| ||
故答案为:Ca2++2HCO3-
| ||
(2)某天然水中c(Ca2+)=1.2×10-3mol?L-1,c(Mg2+)=6×10-4mol?L-1,硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO);1L水中钙离子物质的量=1.2×10-3mol,相当于CaO质量=1.2×10-3mol×56g/mol=67.2mg,1L水中镁离子物质的量=6×10-4mol,相当于氧化镁质量6×10-4mol×40g/mol=24mg,水的硬度=
| 67.2mg |
| 10mg |
| 24mg |
| 7.1mg |
故答案为:是;
(3)聚丙烯酸钠的单体为丙烯钠,结构简式:CH2=CHCOONa,故答案为:CH2=CHCOONa;
(4)铝离子水解生成氢氧化铝和氢离子,离子方程式:Al3++3H2O
 Al(OH)3(胶体)+3H+,
Al(OH)3(胶体)+3H+,故答案为:Al3++3H2O
 Al(OH)3(胶体)+3H+;
Al(OH)3(胶体)+3H+;(5)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过,隔膜B和阴极相连,阴极是阳离子放电,所以隔膜B是阳离子交换膜,
故答案为:B;
②根据阳极是氯离子放电:2Cl--2e-═Cl2↑,阴极区是氢离子得到电子生成氢气,氢氧根离子浓度增大,和钙离子,镁离子形成沉淀,
故答案为:2Cl--2e-═Cl2↑;电极上产生气泡,溶液中出现少量白色沉淀.
点评:本题考查了化学和生活,涉及硬水及其软化,明矾净水等,明确相关概念及电解原理是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在下列各用途中,利用了物质的氧化性的是( )
| A、用食盐腌制食物 |
| B、用漂粉精消毒游泳池中的水 |
| C、用汽油洗涤衣物上的油污 |
| D、用盐酸除去铁钉表面的铁锈 |
下列说法正确的是( )
| A、塑化剂DEHP是指邻苯二甲酸二(2─乙基己)酯,对人体无害,可用作食品添加剂 |
| B、二氧化氮经过加压凝成无色液体为物理变化 |
| C、Na2O?SiO2是一种简单的硅酸盐,可溶于水 |
| D、为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 |
在100mL密度为1.2g/mL稀硝酸中,加入一定量的镁和铜组成的混合物,充分反应后金属完全溶解(假设还原产物只有NO),向反应后溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀质量比原金属质量增加5.1g.则下列叙述不正确是( )
| A、当金属全部溶解时收集到NO气体的体积为2.24L(标准状况) |
| B、当生成沉淀的量最多时,消耗NaOH溶液体积最小为100mL |
| C、原稀硝酸的物质的量浓度一定为4mol/L |
| D、参加反应金属总质量(m)为9.6g>m>3.6g |
人体血液中存在的平衡:H2CO3?H++HCO3-,使血液pH保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒.已知pH随 变化关系如表所示,则下列说法中错误的是( )
| 1.0 | 17.8 | 20.0 | 22.4 | ||||
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
| A、pH=7的血液中,c(HCO3-)>c(H2CO3) | ||||
| B、正常体温下人体发生碱中毒时,c(H+)?c(OH-)变大 | ||||
| C、人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒 | ||||
D、
|
下列反应所得溶液中只含一种溶质的是( )
| A、Fe2(SO4)3溶液中加入过量Fe粉 |
| B、A1(OH)3中加入过量NaOH溶液 |
| C、浓H2SO4中加入过量Cu片,加热 |
| D、Ca(C1O)2溶液中通入过量CO2 |
NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、1mol Zn与足量任意浓度的硫酸反应转移电子数均是2NA |
| B、在常温常压下1molC7H16中含有共价键的总数目是23NA |
| C、0.1molFeCl3完全水解生成Fe(OH)3胶体粒子数目为0.1NA |
| D、33.6L 盐酸在标准状况下所含有HCl分子的数目为1.5NA |
 前四周期原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原子核外的M层中只有两对成对电子,E+核外各能层电子均已充满.请回答下列问题:
前四周期原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原子核外的M层中只有两对成对电子,E+核外各能层电子均已充满.请回答下列问题: