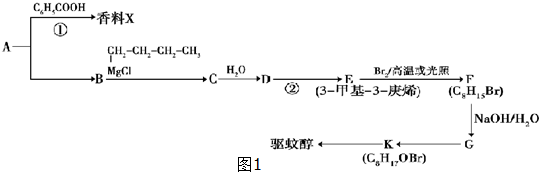
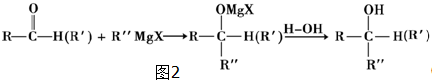
题目内容
人体血液中存在的平衡:H2CO3?H++HCO3-,使血液pH保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒.已知pH随 变化关系如表所示,则下列说法中错误的是( )
| 1.0 | 17.8 | 20.0 | 22.4 | ||||
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
| A、pH=7的血液中,c(HCO3-)>c(H2CO3) | ||||
| B、正常体温下人体发生碱中毒时,c(H+)?c(OH-)变大 | ||||
| C、人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒 | ||||
D、
|
考点:弱电解质在水溶液中的电离平衡
专题:
分析:A.根据图中数据判断,pH=7的血液中,c(HCO3-)>c(H2CO3);
B.温度不变,水的离子积常数不变;
C.人体发生酸中毒时,可静脉滴注一定浓度的碱性NaHCO3溶液解毒;
D.碳酸的电离程度小于碳酸氢根离子水解程度时,溶液显碱性.
B.温度不变,水的离子积常数不变;
C.人体发生酸中毒时,可静脉滴注一定浓度的碱性NaHCO3溶液解毒;
D.碳酸的电离程度小于碳酸氢根离子水解程度时,溶液显碱性.
解答:
解:A.根据图中数据判断,当pH=6.10时,c(HCO3-)=c(H2CO3),当pH>6.10时,c(HCO3-)>c(H2CO3),所以pH=7的血液中,c(HCO3-)>c(H2CO3),故A正确;
B.温度不变,水的离子积常数不变,所以正常体温下c(H+)?c(OH-)不变,故B错误;
C.人体发生酸中毒时,可静脉滴注弱碱性物质解毒,碳酸氢钠溶液呈弱碱性,所以人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒,故C正确;
D.由表中数据可知,
=20.0时,溶液呈碱性,说明碳酸的电离程度小于碳酸氢根离子水解程度,故D正确;
故选B.
B.温度不变,水的离子积常数不变,所以正常体温下c(H+)?c(OH-)不变,故B错误;
C.人体发生酸中毒时,可静脉滴注弱碱性物质解毒,碳酸氢钠溶液呈弱碱性,所以人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒,故C正确;
D.由表中数据可知,
| c(HCO3-) |
| c(H2CO3) |
故选B.
点评:本题考查了盐类水解,正确理解表中数据之间的关系是解本题关键,再结合弱电解质的电离、盐类水解特点来分析解答,题目难度不大.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
科学家设想利用乙二醇和CO2生产可降解塑料聚碳酸酯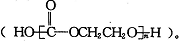 下列有关说法不正确的是( )
下列有关说法不正确的是( )
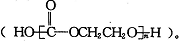 下列有关说法不正确的是( )
下列有关说法不正确的是( )| A、乙二醇可作汽车抗冻液 |
| B、减少CO2的排放可防止酸雨 |
| C、该塑料是一种有机高分子材料 |
| D、链节上酯基的水解有利于降解发生 |
下列说法正确的是( )
| A、常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| B、用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 |
| C、在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
| D、物质的溶解度随温度的升高而增加,物质的溶解都是吸热的 |
下列叙述正确的是( )
| A、Na2SO3溶液中通入CO2溶液变浑浊,继续通入CO2至过量,浑浊消失 |
| B、均不能采取将溶液直接蒸干的方法制得AlCl3、Al2( SO4)3、Fe Cl3、Fe2( SO4)3 |
| C、Na、Mg、Cl是海水中的重要元素,从海水中制备这三种元素单质的反应都定存在氧化还原反应 |
D、元素X的单质及元素X与Y形成的化合物能按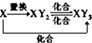 关系发生转化,则X可为Fe或S 关系发生转化,则X可为Fe或S |
2013年,中国“雾霾”天气频发,受到社会广泛关注.下列措施不可能改善空气质量的是( )
| A、应用高效洁净的能源转换技术,在大型燃煤锅炉上安装低氮燃烧器,并采用烟气脱硝技术 |
| B、加强道路扬尘控制强化路面保洁洒水防尘 |
| C、推广和使用脱硫技术,降低硫氧化物的排放 |
| D、研究采煤、采油新技术增加汽油、柴油等能源的供应量,提倡以汽车代步的现代消费与生活理念 |
下列反应的离子方程式正确的是( )
| A、钠和硫酸铜溶液反应:2Na+Cu2+=2Na++Cu |
| B、AlCl3溶液中加入足量的氨水制Al(OH)3:Al3++3OH-=Al(OH)3↓ |
| C、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| D、二氧化硅溶于NaOH溶液:SiO2+2OH-=SiO32-+H2O |