题目内容
在100mL密度为1.2g/mL稀硝酸中,加入一定量的镁和铜组成的混合物,充分反应后金属完全溶解(假设还原产物只有NO),向反应后溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀质量比原金属质量增加5.1g.则下列叙述不正确是( )
| A、当金属全部溶解时收集到NO气体的体积为2.24L(标准状况) |
| B、当生成沉淀的量最多时,消耗NaOH溶液体积最小为100mL |
| C、原稀硝酸的物质的量浓度一定为4mol/L |
| D、参加反应金属总质量(m)为9.6g>m>3.6g |
考点:有关混合物反应的计算,化学方程式的有关计算
专题:计算题
分析:发生反应方程式为:3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,
向反应后的溶液中加入过量的3mol/L NaOH溶液至沉淀完全,发生反应为:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为
=0.3mol,根据电子转移守恒,则镁和铜的总的物质的量为:0.3mol×
=0.15mol,据此对各选项进行计算和判断.
向反应后的溶液中加入过量的3mol/L NaOH溶液至沉淀完全,发生反应为:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为
| 5.1g |
| 17g/mol |
| 1 |
| 2 |
解答:
解:将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),发生反应:3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;向反应后的溶液中加入过量的3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3;Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为0.3mol,根据电子转移守恒,则镁和铜的总的物质的量为:0.3mol×
=0.15mol,
A.镁和铜的总的物质的量为0.15mol,根据电子转移守恒可知生成的NO物质的量为0.15mol×
=0.1mol,标准状况下生成NO的体积为:0.1mol×22.4L/mol=2.24L,故A正确;
B.若硝酸无剩余,则参加反应氢氧化钠的物质的量等于0.3mol,需要氢氧化钠溶液的体积=0.3mol/3mol/L=0.1L=100mL;硝酸若有剩余,消耗的氢氧化钠溶液体积大于100mL,故B正确;
C.根据方程式可知参加反应的n反应(HNO3)=
n(金属)=0.15mol×
=0.4mol,硝酸有可能有剩余,故C错误;
D.镁和铜的总的物质的量为0.15mol,假定全为镁,质量为0.15mol×24g/mol=3.6g,若全为铜,质量为0.15mol×64g/mol=9.6g,所以参加反应的金属的总质量(m)为9.6g>m>3.6g,故D正确;
故选C.
| 1 |
| 2 |
A.镁和铜的总的物质的量为0.15mol,根据电子转移守恒可知生成的NO物质的量为0.15mol×
| 2 |
| 3 |
B.若硝酸无剩余,则参加反应氢氧化钠的物质的量等于0.3mol,需要氢氧化钠溶液的体积=0.3mol/3mol/L=0.1L=100mL;硝酸若有剩余,消耗的氢氧化钠溶液体积大于100mL,故B正确;
C.根据方程式可知参加反应的n反应(HNO3)=
| 8 |
| 3 |
| 8 |
| 3 |
D.镁和铜的总的物质的量为0.15mol,假定全为镁,质量为0.15mol×24g/mol=3.6g,若全为铜,质量为0.15mol×64g/mol=9.6g,所以参加反应的金属的总质量(m)为9.6g>m>3.6g,故D正确;
故选C.
点评:本题考查混合物反应的计算、化学反应方程式的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握质量守恒定律、电子守恒在化学计算中的应用方法,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
下列推断或表述正确的是( )
| A、25℃时,pH=4.7浓度均为0.1mol?L-1的CH2COOH、CH3COONa混合溶液中,c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
| B、常温下,氨水与(NH4)2SO4溶液混合所得pH=7的溶液中,c(NH4+):c(SO42-)=2:1 |
| C、将体积相同,pH均为1的盐酸和醋酸分别加水稀释至pH=3,盐酸的体积变化大,证明醋酸是弱酸 |
| D、向2.0ml浓度均为0.1mol?L-1的KCl、KI混合液中滴加1-2滴0.01mol?L-1AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp小 |
下列有关实验的说法不正确的是( )


| A、用广泛pH试纸测得0.051 mol?L-1 H2SO4溶液的pH=1 |
| B、某气体制备装置如右图,该装置可减少污染性气体的泄漏,且有利于收集到空气含量较低的气体 |
| C、在分液操作中,当试液分层后,打开旋塞,将下层液体放出,然后关闭旋塞,将上层液体从上口倒出 |
| D、10mL溴水与5mL正己烷混合,在光照下振荡后静置,当试液分为上、下两层且几乎无色时,用玻璃棒蘸取浓氨水伸入液面上方,可观察到有白烟生成 |
一定质量的铁铝合金完全溶于过量的稀硝酸中,反应过程中共产生4.48LNO(标准状况下测定),若在反应后的溶液中加入足量的氢氧化物溶液,则生成沉淀的质量不可能是( )
| A、21.4g | B、18.7g |
| C、15.6g | D、7.8g |
下列说法正确的是( )
| A、常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| B、用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 |
| C、在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
| D、物质的溶解度随温度的升高而增加,物质的溶解都是吸热的 |
下列叙述正确的是( )
| A、Na2SO3溶液中通入CO2溶液变浑浊,继续通入CO2至过量,浑浊消失 |
| B、均不能采取将溶液直接蒸干的方法制得AlCl3、Al2( SO4)3、Fe Cl3、Fe2( SO4)3 |
| C、Na、Mg、Cl是海水中的重要元素,从海水中制备这三种元素单质的反应都定存在氧化还原反应 |
D、元素X的单质及元素X与Y形成的化合物能按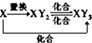 关系发生转化,则X可为Fe或S 关系发生转化,则X可为Fe或S |
下列关于氨分子的化学用语错误的是( )
| A、化学式:NH3 |
B、电子式: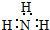 |
C、结构式: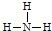 |
D、比例模型: |