题目内容
NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、1mol Zn与足量任意浓度的硫酸反应转移电子数均是2NA |
| B、在常温常压下1molC7H16中含有共价键的总数目是23NA |
| C、0.1molFeCl3完全水解生成Fe(OH)3胶体粒子数目为0.1NA |
| D、33.6L 盐酸在标准状况下所含有HCl分子的数目为1.5NA |
考点:阿伏加德罗常数
专题:
分析:A.锌为+2价金属,1mol锌完全反应失去2mol电子;
B.庚烷分子中含有6mol碳碳键、16mol碳氢键,总共含有22mol共价键;
C.氢氧化铁胶粒为氢氧化铁的聚集体;
D.标况下盐酸为液体,不能使用标况下气体摩尔体积计算氯化氢的物质的量.
B.庚烷分子中含有6mol碳碳键、16mol碳氢键,总共含有22mol共价键;
C.氢氧化铁胶粒为氢氧化铁的聚集体;
D.标况下盐酸为液体,不能使用标况下气体摩尔体积计算氯化氢的物质的量.
解答:
解:A.1mol锌与足量任意浓度的硫酸反应生成1mol硫酸锌,反应中失去2mol电子,转移电子数均是2NA,故A正确;
B.在常温常压下1molC7H16中含有6mol碳碳键、16mol碳氢键,总共含有22mol共价键,含有共价键的总数目是22NA,故B错误;
C.氢氧化铁胶体中,胶粒为氢氧化铁的聚集体,无法计算溶液中含有胶粒数目,故C错误;
D.标准状况下,盐酸不是气体,不能使用标况下的气体摩尔体积计算33.6L氯化氢的物质的量,故D错误;
故选A.
B.在常温常压下1molC7H16中含有6mol碳碳键、16mol碳氢键,总共含有22mol共价键,含有共价键的总数目是22NA,故B错误;
C.氢氧化铁胶体中,胶粒为氢氧化铁的聚集体,无法计算溶液中含有胶粒数目,故C错误;
D.标准状况下,盐酸不是气体,不能使用标况下的气体摩尔体积计算33.6L氯化氢的物质的量,故D错误;
故选A.
点评:本题考查阿伏加德罗常数的应用,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,B为易错点,注意氢氧化铁胶粒为氢氧化铁的聚集体.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
2013年,中国“雾霾”天气频发,受到社会广泛关注.下列措施不可能改善空气质量的是( )
| A、应用高效洁净的能源转换技术,在大型燃煤锅炉上安装低氮燃烧器,并采用烟气脱硝技术 |
| B、加强道路扬尘控制强化路面保洁洒水防尘 |
| C、推广和使用脱硫技术,降低硫氧化物的排放 |
| D、研究采煤、采油新技术增加汽油、柴油等能源的供应量,提倡以汽车代步的现代消费与生活理念 |
铯(Cs)在自然界中只有一种稳定同位素13355Cs,核泄漏事故中会产生人工放射性同位素
Cs、
Cs.下列有关说法正确的是( )
134 55 |
137 55 |
| A、铯元素的相对原子质量约为133 | ||||
B、
| ||||
C、
| ||||
D、
|
下列关于氨分子的化学用语错误的是( )
| A、化学式:NH3 |
B、电子式: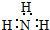 |
C、结构式: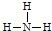 |
D、比例模型: |
设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A、在1L0.1mol/L AlCl3溶液中含有0.1NA个Al3+ |
| B、Na2O2与足量水反应,每生成0.1molO2转移的电子数为0.2NA |
| C、标准状况下,2.24LCO和CO2混合气体中含有的碳原子数目为0.2NA |
| D、标准状况下,11.2L四氯化碳中含有的C-Cl键的个数为2NA |
下列反应的离子方程式正确的是( )
| A、钠和硫酸铜溶液反应:2Na+Cu2+=2Na++Cu |
| B、AlCl3溶液中加入足量的氨水制Al(OH)3:Al3++3OH-=Al(OH)3↓ |
| C、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| D、二氧化硅溶于NaOH溶液:SiO2+2OH-=SiO32-+H2O |
关于CO2说法正确的是( )
| A、碳原子采取sp杂化 |
| B、CO2是正四面体型结构 |
| C、干冰是原子晶体 |
| D、CO2为极性分子 |
