题目内容
已知物质A、B、C、D、E是由短周期元素构成的单质或化合物,它们可发生如图所示的转化关系:
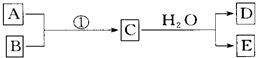
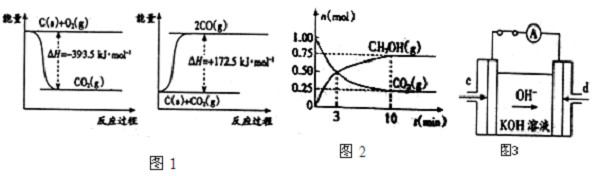
(1)若条件①为点燃,目前60%的B都是从海水中提取的,气体D可以使湿润的红色石蕊试纸变蓝,写出C与H2O反应的化学方程式 .将气体D作为燃料电池的燃料源可以制成D-空气燃料电池系统,总反应式为:D+O2→A+H2O(未配平),写出此碱性燃料电池的负极反应式: .
(2)若条件①为加热,E是一种两性氢氧化物,气体D是一种有臭鸡蛋气味的气体,其水溶液是还原性酸,则C为 (写化学式).
(3)若条件①为常温,B和D为同种无色气体,常温下E的浓溶液可以使Fe钝化,写出少量Fe粉与E的稀溶液反应的离子方程式: .已知常温下1molC与H2O反应生成气体D和E溶液放出46kJ热量,写出C与水反应生成D和E的热化学方程式: .

(1)若条件①为点燃,目前60%的B都是从海水中提取的,气体D可以使湿润的红色石蕊试纸变蓝,写出C与H2O反应的化学方程式
(2)若条件①为加热,E是一种两性氢氧化物,气体D是一种有臭鸡蛋气味的气体,其水溶液是还原性酸,则C为
(3)若条件①为常温,B和D为同种无色气体,常温下E的浓溶液可以使Fe钝化,写出少量Fe粉与E的稀溶液反应的离子方程式:
考点:无机物的推断
专题:推断题
分析:(1)若条件①为点燃,目前60%的B都是从海水中提取的,则B是Mg,气体D可以使湿润的红色石蕊试纸变蓝,则D是NH3,C和水反应生成氨气和E,根据元素守恒知,A中含有氮元素,Mg和氮气能发生生成C为氮化镁,所以A是氮气,氮化镁和水反应生成氨气和氢氧化镁,据此写出反应方程式;碱性氨气燃料电池中,负极上氨气失电子发生氧化反应;
(2)若条件①为加热,E是一种两性氢氧化物,则E是氢氧化铝,气体D是一种有臭鸡蛋气味的气体,其水溶液是还原性酸,则D是硫化氢,根据元素守恒知,C是硫化铝,据此答题;
(3)若条件①为常温,B和D为同-种无色气体,常温下E的浓溶液可以使Fe钝化,则E是硝酸,D是一氧化氮,C是二氧化氮,A是氧气,少量Fe粉和稀硝酸反应生成硝酸铁、一氧化氮和水;1mol二氧化氮与H2O反应生成气体D和E溶液放出46kJ热量,则3mol二氧化氮与H2O反应放出138kJ的热,据此写热化学方程式.
(2)若条件①为加热,E是一种两性氢氧化物,则E是氢氧化铝,气体D是一种有臭鸡蛋气味的气体,其水溶液是还原性酸,则D是硫化氢,根据元素守恒知,C是硫化铝,据此答题;
(3)若条件①为常温,B和D为同-种无色气体,常温下E的浓溶液可以使Fe钝化,则E是硝酸,D是一氧化氮,C是二氧化氮,A是氧气,少量Fe粉和稀硝酸反应生成硝酸铁、一氧化氮和水;1mol二氧化氮与H2O反应生成气体D和E溶液放出46kJ热量,则3mol二氧化氮与H2O反应放出138kJ的热,据此写热化学方程式.
解答:
解:(1)若条件①为点燃,目前60%的B都是从海水中提取的,则B是Mg,气体D可以使湿润的红色石蕊试纸变蓝,则D是NH3,C和水反应生成氨气和E,根据元素守恒知,A中含有氮元素,Mg和氮气能发生生成C为氮化镁,所以A是氮气,氮化镁和水反应生成氨气和氢氧化镁,所以其反应方程式为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;碱性氨气燃料电池中,负极上氨气失电子发生氧化反应,电极反应式为:2NH3+6OH--6e-=N2↑+6H2O,
故答案为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;2NH3+6OH--6e-=N2↑+6H2O;
(2)若条件①为加热,E是一种两性氢氧化物,则E是氢氧化铝,气体D是一种有臭鸡蛋气味的气体,其水溶液是还原性酸,则D是硫化氢,根据元素守恒知,C是硫化铝,
故答案为:Al2S3;
(3)若条件①为常温,B和D为同-种无色气体,常温下E的浓溶液可以使Fe钝化,则E是硝酸,D是一氧化氮,C是二氧化氮,A是氧气,少量Fe粉和稀硝酸反应生成硝酸铁、一氧化氮和水,反应的离子方程式为:Fe+4H++NO3-=Fe3++NO↑+2H2O;1mol二氧化氮与H2O反应生成气体D和E溶液放出46kJ热量,则3mol二氧化氮与H2O反应放出138kJ的热,所以反应的热化学方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O;3NO2(g)+H2O(l)=2HNO3(aq)+NO(g),△H=-138kJ/mol,
故答案为:Fe+4H++NO3-=Fe3++NO↑+2H2O;3NO2(g)+H2O(l)=2HNO3(aq)+NO(g),△H=-138kJ/mol.
故答案为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;2NH3+6OH--6e-=N2↑+6H2O;
(2)若条件①为加热,E是一种两性氢氧化物,则E是氢氧化铝,气体D是一种有臭鸡蛋气味的气体,其水溶液是还原性酸,则D是硫化氢,根据元素守恒知,C是硫化铝,
故答案为:Al2S3;
(3)若条件①为常温,B和D为同-种无色气体,常温下E的浓溶液可以使Fe钝化,则E是硝酸,D是一氧化氮,C是二氧化氮,A是氧气,少量Fe粉和稀硝酸反应生成硝酸铁、一氧化氮和水,反应的离子方程式为:Fe+4H++NO3-=Fe3++NO↑+2H2O;1mol二氧化氮与H2O反应生成气体D和E溶液放出46kJ热量,则3mol二氧化氮与H2O反应放出138kJ的热,所以反应的热化学方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O;3NO2(g)+H2O(l)=2HNO3(aq)+NO(g),△H=-138kJ/mol,
故答案为:Fe+4H++NO3-=Fe3++NO↑+2H2O;3NO2(g)+H2O(l)=2HNO3(aq)+NO(g),△H=-138kJ/mol.
点评:本题考查了元素化合物的性质,正确推断物质是解本题关键,明确物质的特殊性质即可解答,难度中等.

练习册系列答案
相关题目
 假蜜环菌甲素可作为药物用于治疗急性胆道感染病毒性肝炎等疾病,其结构简式如下.下列对假蜜环菌甲素的性质叙述正确的是( )
假蜜环菌甲素可作为药物用于治疗急性胆道感染病毒性肝炎等疾病,其结构简式如下.下列对假蜜环菌甲素的性质叙述正确的是( )| A、假蜜环菌甲素可以发生消去反应 |
| B、1 mol假蜜环菌甲素可与 6 molH2发生加成反应 |
| C、假蜜环菌甲素可与 NaOH 溶液在加热条件下发生水解反应 |
| D、假蜜环菌甲素既能与Na反应生成H2,又能与NaHCO3反应生成CO2 |
结合你所学的有机化学基础知识,判断下列说法中正确的是( )
| A、煤的干馏和石油的分馏均属于化学变化 |
| B、将碘酒滴在鸡蛋清中,可观察到鸡蛋清显蓝色 |
| C、乙酸的酯化反应和苯的硝化反应属于同种反应类型 |
| D、乙烯能够发生加成反应,结构简式为CH2CH2 |
铯(Cs)在自然界中只有一种稳定同位素13355Cs,核泄漏事故中会产生人工放射性同位素
Cs、
Cs.下列有关说法正确的是( )
134 55 |
137 55 |
| A、铯元素的相对原子质量约为133 | ||||
B、
| ||||
C、
| ||||
D、
|