题目内容
将一小粒钠投入氯化铜溶液中,待反应停止后,观察到的现象是( )
| A、有蓝色沉淀 |
| B、有蓝色沉淀和气体产生 |
| C、有气体产生,无沉淀生成 |
| D、无沉淀和有气体产生 |
考点:钠的化学性质
专题:
分析:钠的密度比水小,熔点低,将一小块钠投入到氯化铜溶液中,钠先和水反应生成NaOH和氢气,且同时放出大量热,生成的NaOH和氯化铜发生复分解反应生成蓝色沉淀Cu(OH)2,据此分析解答.
解答:
解:钠的密度小于水,钠会浮在水面上;钠和水剧烈反应生成氢氧化钠和氢气,且该反应是放热反应,放出的热量使钠熔成小球,且会有嘶嘶的响声;
钠和水反应生成的氢氧化钠能和氯化铜发生复分解反应生成蓝色的氢氧化铜沉淀,所以溶液中会有蓝色沉淀生成,既有沉淀生成又有气体生成,
故选B.
钠和水反应生成的氢氧化钠能和氯化铜发生复分解反应生成蓝色的氢氧化铜沉淀,所以溶液中会有蓝色沉淀生成,既有沉淀生成又有气体生成,
故选B.
点评:本题考查了钠的与硫酸铜溶液反应现象,明确钠的性质是解本题关键,结合钠的密度、熔点、化学性质等来分析解答即可,难度不大.

练习册系列答案
相关题目
某化学实验报告中有如下记录,其中实验数据合理的是( )
| A、用托盘天平称取11.7 g CuO粉末 |
| B、用广泛的pH试纸测得溶液的pH为6.2 |
| C、温度计显示的室温读数为25.69℃ |
| D、用100 mL量筒量取5.6 mL的稀硝酸 |
下列各组离子能在指定环境中大量共存的是( )
| A、在C(HCO3-)=0.1mol/L的溶液中NH4+、Al3+、Cl-、NO3- |
| B、在由水电离出的C(H+)=1×10-12mol/L的溶液中AlO2-、HCO3-、Na+、SO42- |
| C、在使红色石蕊试纸变蓝的溶液中SO32-、CO32-、Na+、K+ |
| D、pH=1的溶液中Mg2+、Fe2+、NO3-、Cl- |
常温下,下列溶液pH小于7的是( )
| A、CH3COONa |
| B、CuSO4 |
| C、NaOH |
| D、Na2CO3 |
合金是指两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质.分析下表中的数据,不能形成合金的是( )
| Na | Cu | Al | Fe | |
| 熔点/℃ | 97.8 | 1083 | 660 | 1535 |
| 沸点/℃ | 883 | 2567 | 2467 | 2750 |
| A、Cu和Al |
| B、Fe和Cu |
| C、Cu和Na |
| D、Al和Na |
PH=3的盐酸和醋酸各100mL,分别和锌反应,反应完后,放出的气体一样多.若最后有一溶液中锌剩余,则下列判断正确的是( )
| A、反应开始时速率v(HCl)>v(CH3COOH) |
| B、加入的锌质量相等 |
| C、盐酸中锌有剩余 |
| D、反应开始后不久,醋酸反应的速率小于盐酸 |
 反应aX(g)+bY(g)cZ(g),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )
反应aX(g)+bY(g)cZ(g),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )| A、T1<T2,P1<P2,a+b<c正反应是吸热反应 |
| B、T1<T2,P1>P2,a+b<c正反应是吸热反应 |
| C、T1>T2,P1>P2,a+b>c逆反应是吸热反应 |
| D、T1>T2,P1<P2,a+b>c逆反应是吸热反应 |
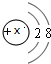 ,则该元素氧化物的化学式为
,则该元素氧化物的化学式为