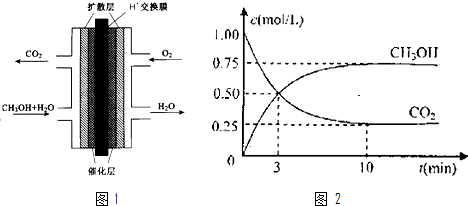
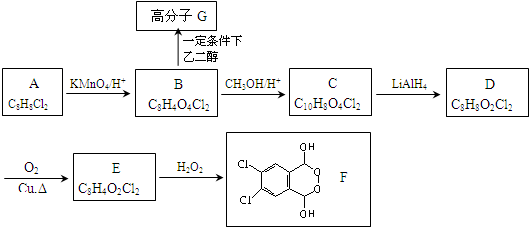
题目内容
某元素R3+离子的结构示意图为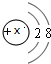 ,则该元素氧化物的化学式为 ,1mol该元素的单质跟足量稀H2SO4反应,转移的电子数为 mol,生成氢气的体积(标准状况)为 L.
,则该元素氧化物的化学式为 ,1mol该元素的单质跟足量稀H2SO4反应,转移的电子数为 mol,生成氢气的体积(标准状况)为 L.
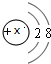 ,则该元素氧化物的化学式为
,则该元素氧化物的化学式为考点:物质的量的相关计算,原子结构示意图,根据化合价正确书写化学式(分子式)
专题:
分析:某元素R3+离子的结构示意图为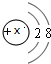 ,R原子质子数为2+8+3=13,为Al元素,根据化合价书写氧化物化学式,计算电子转移数目,根据电子转移守恒计算生成氢气的体积.
,R原子质子数为2+8+3=13,为Al元素,根据化合价书写氧化物化学式,计算电子转移数目,根据电子转移守恒计算生成氢气的体积.
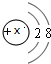 ,R原子质子数为2+8+3=13,为Al元素,根据化合价书写氧化物化学式,计算电子转移数目,根据电子转移守恒计算生成氢气的体积.
,R原子质子数为2+8+3=13,为Al元素,根据化合价书写氧化物化学式,计算电子转移数目,根据电子转移守恒计算生成氢气的体积.解答:
解:某元素R3+离子的结构示意图为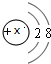 ,R原子质子数为2+8+3=13,为Al元素,其氧化物化学式为Al2O3,Al与硫酸反应时生成硫酸铝与氢气,转移电子为1mol×3=3mol,根据电子转移守恒,生成氢气的物质的量为
,R原子质子数为2+8+3=13,为Al元素,其氧化物化学式为Al2O3,Al与硫酸反应时生成硫酸铝与氢气,转移电子为1mol×3=3mol,根据电子转移守恒,生成氢气的物质的量为
×22.4L/mol=33.6L,
故答案为:Al2O3;3;33.6.
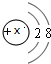 ,R原子质子数为2+8+3=13,为Al元素,其氧化物化学式为Al2O3,Al与硫酸反应时生成硫酸铝与氢气,转移电子为1mol×3=3mol,根据电子转移守恒,生成氢气的物质的量为
,R原子质子数为2+8+3=13,为Al元素,其氧化物化学式为Al2O3,Al与硫酸反应时生成硫酸铝与氢气,转移电子为1mol×3=3mol,根据电子转移守恒,生成氢气的物质的量为| 3mol |
| 2 |
故答案为:Al2O3;3;33.6.
点评:本题考查核外电子排布、电子转移数目计算、化学方程式有关计算等,比较基础,有利于基础知识的巩固.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
将一小粒钠投入氯化铜溶液中,待反应停止后,观察到的现象是( )
| A、有蓝色沉淀 |
| B、有蓝色沉淀和气体产生 |
| C、有气体产生,无沉淀生成 |
| D、无沉淀和有气体产生 |
下列有关热化学方程式的书写及对应的表述均正确的是( )
| A、密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ?mol-1 |
| B、稀醋酸与0.1 mol?L-1 NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ?mol-1 |
| C、已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ?mol-1 |
| D、已知2C(s)+O2(g)=2CO(g)△H=-221 kJ?mol-1,则可知C的燃烧热△H=-110.5 kJ?mol-1 |
有反应4HCl+O2→2Cl2+2H2O,已知2molO2被还原时,放出a kJ的热量,且知断开1mol
O2需要吸收b kJ的热量,断开1molCl2需要吸收c kJ的热量.则断开1mol H-O键比断开1molH-Cl 键所需能量高( )
O2需要吸收b kJ的热量,断开1molCl2需要吸收c kJ的热量.则断开1mol H-O键比断开1molH-Cl 键所需能量高( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列电离方程式错误的是( )
| A、H2CO3?2H++CO32- |
| B、NaHSO4(溶液)=Na++H++SO42- |
| C、NaHCO3=Na++HCO3- |
| D、Ba (OH)2=Ba2++2OH- |
已知NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A、氯化铁溶液加热蒸干最终得不到氯化铁固体 |
| B、镀锡的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀 |
| C、电解精炼铜时,每转移2 mol电子阳极上溶解的铜原子数为NA |
| D、在lL0.lmol.L-1碳酸钠溶液中,阴离子总数大于0.1NA |
下列反应的离子方程式书写正确的是( )
| A、硫酸铝溶液中加入过量氨水 Al3++3OH-=Al(OH)3↓ | ||||
B、电解饱和食盐水 2Cl-+2H+
| ||||
| C、在稀氨水中通入过量CO2 NH3?H2O+CO2=NH4++HCO3- | ||||
| D、硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2═Fe3++2H2O |