题目内容
NOx是汽车尾气中的主要污染物之一.
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_ .
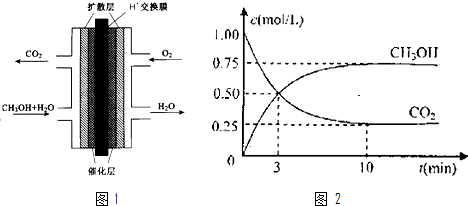
(2)汽车发动机工作时会引发N2和02反应,其能量变化示意图1如下:

①写出该反应的热化方程式: .
②随温度升高,该反应化学平衡常数的变化趋势是 .
(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放.当尾气中空气不足时,NOX在催化转化器中被还原成N2排出.写出NO被CO还原的化学方程式 .
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图2如下:
①Pt为 电极(填“正极”或“负极”),发生的是 反应(填“氧化”或“还原”).
②NiO为 电极(填“正极”或“负极”),电极反应式: .
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_
(2)汽车发动机工作时会引发N2和02反应,其能量变化示意图1如下:

①写出该反应的热化方程式:
②随温度升高,该反应化学平衡常数的变化趋势是
(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放.当尾气中空气不足时,NOX在催化转化器中被还原成N2排出.写出NO被CO还原的化学方程式
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图2如下:
①Pt为
②NiO为
考点:氮的氧化物的性质及其对环境的影响,化学电源新型电池
专题:
分析:(1)二氧化氮和水反应生成硝酸和一氧化氮;
(2)①根据能量变化图计算反应热,反应热=吸收的能量-放出的能量,再根据热化学反应方程式的书写规则书写;
②温度升高,平衡向吸热方向移动;
(3)NO被CO还原,则CO被NO氧化生成二氧化碳,据此写出反应方程式;
(4)①原电池中正极得电子的物质发生还原反应;
②NiO电极上NO失电子和氧离子反应生成二氧化氮.
(2)①根据能量变化图计算反应热,反应热=吸收的能量-放出的能量,再根据热化学反应方程式的书写规则书写;
②温度升高,平衡向吸热方向移动;
(3)NO被CO还原,则CO被NO氧化生成二氧化碳,据此写出反应方程式;
(4)①原电池中正极得电子的物质发生还原反应;
②NiO电极上NO失电子和氧离子反应生成二氧化氮.
解答:
解:(1)二氧化氮和水反应生成硝酸和一氧化氮,反应方程式为:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
(2)①该反应中的反应热=(945+498)kJ/mol-2×630kJ/mol=+183kJ/mol,所以其热化学反应方程式为:N2(g)+O2(g)=2NO(g)△H=+183 kJ?moL-1,故答案为:N2(g)+O2(g)=2NO(g)△H=+183 kJ?moL-1;
②温度升高,平衡向吸热方向移动,化学平衡常数增大,故答案为:增大;
(3)在催化剂条件下,一氧化碳被氧化生成二氧化碳,一氧化氮被还原生成氮气,所以其反应方程式为:2CO+2NO
N2+2CO2,故答案为:2CO+2NO
N2+2CO2;
(4)①装置无外接电源,故为原电池,铂电极上氧气得电子生成氧离子而被还原,所以为正极,发生还原反应,故答案为:正;还原;
②NiO电极上NO失电子和氧离子反应生成二氧化氮,NiO为负极,所以电极反应式为:NO+O2--2e-=NO2,故答案为:负极;NO+O2--2e-=NO2.
故答案为:3NO2+H2O=2HNO3+NO;
(2)①该反应中的反应热=(945+498)kJ/mol-2×630kJ/mol=+183kJ/mol,所以其热化学反应方程式为:N2(g)+O2(g)=2NO(g)△H=+183 kJ?moL-1,故答案为:N2(g)+O2(g)=2NO(g)△H=+183 kJ?moL-1;
②温度升高,平衡向吸热方向移动,化学平衡常数增大,故答案为:增大;
(3)在催化剂条件下,一氧化碳被氧化生成二氧化碳,一氧化氮被还原生成氮气,所以其反应方程式为:2CO+2NO
| ||
| ||
(4)①装置无外接电源,故为原电池,铂电极上氧气得电子生成氧离子而被还原,所以为正极,发生还原反应,故答案为:正;还原;
②NiO电极上NO失电子和氧离子反应生成二氧化氮,NiO为负极,所以电极反应式为:NO+O2--2e-=NO2,故答案为:负极;NO+O2--2e-=NO2.
点评:本题涉及化学反应方程式、热化学反应方程式、电极反应式的书写等知识点,注意反应热的计算方法,为易错点,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
化学与生活密切相关,下列说法不正确的是( )
| A、二氧化硫与氯气混合后漂白性将会减弱甚至消失 |
| B、蛋白质,油脂,纤维素是天然的高分子材料 |
| C、聚乙烯塑料制品可用于食品的包装 |
| D、次氯酸钠溶液可用于环境的消毒杀菌 |
将煤处理后变为气体燃料的目的是( )
| A、提高煤的价格 |
| B、提高燃烧效率,减少大气污染 |
| C、方便存放 |
| D、方便运输 |
将一小粒钠投入氯化铜溶液中,待反应停止后,观察到的现象是( )
| A、有蓝色沉淀 |
| B、有蓝色沉淀和气体产生 |
| C、有气体产生,无沉淀生成 |
| D、无沉淀和有气体产生 |
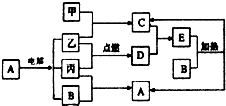 下列如框图2所示的物质转化关系中,甲、乙、丙是常见的气体单质.气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略去).
下列如框图2所示的物质转化关系中,甲、乙、丙是常见的气体单质.气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略去).