题目内容
PH=3的盐酸和醋酸各100mL,分别和锌反应,反应完后,放出的气体一样多.若最后有一溶液中锌剩余,则下列判断正确的是( )
| A、反应开始时速率v(HCl)>v(CH3COOH) |
| B、加入的锌质量相等 |
| C、盐酸中锌有剩余 |
| D、反应开始后不久,醋酸反应的速率小于盐酸 |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:c(H+)相同的盐酸和醋酸溶液中,c(CH3COOH)>c(HCl),相同体积、c(H+)相同时n(CH3COOH)>n(HCl),反应过程中醋酸继续电离出氢离子,反应速率与c(H+)成正比,则生成相同量的氢气时,反应速率与反应时间成反比,根据氢气和锌之间的关系式计算,据此分析解答.
解答:
解:A、c(H+)相同,开始时反应速率相同,故A错误;
B、根据氢气和锌之间的关系式知,生成相同质量的H2需要的m(Zn)相等,有一溶液中锌剩余,所以加入的锌质量不相等,故B错误;
C、氢离子浓度、体积相同的醋酸和盐酸,醋酸的物质的量大于盐酸,所以盐酸中锌有剩余,故C正确;
D、相同体积、c(H+)相同时n(CH3COOH)>n(HCl),反应过程中醋酸继续电离出氢离子,反应速率与c(H+)成正比,反应开始后不久,醋酸反应的速率大于盐酸,故D错误;
故选C.
B、根据氢气和锌之间的关系式知,生成相同质量的H2需要的m(Zn)相等,有一溶液中锌剩余,所以加入的锌质量不相等,故B错误;
C、氢离子浓度、体积相同的醋酸和盐酸,醋酸的物质的量大于盐酸,所以盐酸中锌有剩余,故C正确;
D、相同体积、c(H+)相同时n(CH3COOH)>n(HCl),反应过程中醋酸继续电离出氢离子,反应速率与c(H+)成正比,反应开始后不久,醋酸反应的速率大于盐酸,故D错误;
故选C.
点评:本题考查了弱电解质的电离,明确弱电解质的电离特点是解本题关键,注意反应速率与电解质强弱无关,只与氢离子浓度成正比,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将一小粒钠投入氯化铜溶液中,待反应停止后,观察到的现象是( )
| A、有蓝色沉淀 |
| B、有蓝色沉淀和气体产生 |
| C、有气体产生,无沉淀生成 |
| D、无沉淀和有气体产生 |
下列物质不能通过单质间化合反应制取的是( )
| A、Na2O2 |
| B、FeCl2 |
| C、SO2 |
| D、HCl |
下列说法正确的是( )
| A、KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| B、HClO是弱酸,所以NaClO是弱电解质 |
| C、HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| D、杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质 |
反应2SO2+O2
2SO3+Q达到化学平衡状态时的标志是( )
| 催化剂 |
| A、SO2的消耗速率等于SO3的生成速率 |
| B、SO2的生成速率等于SO3的生成速率 |
| C、SO2的消耗速率大于O2生成速率的2倍 |
| D、SO3的生成速率等于O2的生成速率 |
已知NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A、氯化铁溶液加热蒸干最终得不到氯化铁固体 |
| B、镀锡的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀 |
| C、电解精炼铜时,每转移2 mol电子阳极上溶解的铜原子数为NA |
| D、在lL0.lmol.L-1碳酸钠溶液中,阴离子总数大于0.1NA |
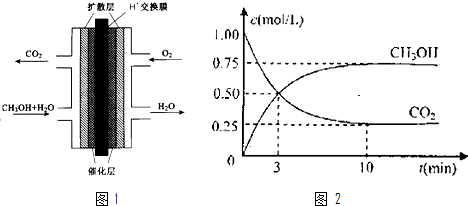
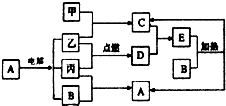 下列如框图2所示的物质转化关系中,甲、乙、丙是常见的气体单质.气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略去).
下列如框图2所示的物质转化关系中,甲、乙、丙是常见的气体单质.气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略去).