题目内容
下列各组离子能在指定环境中大量共存的是( )
| A、在C(HCO3-)=0.1mol/L的溶液中NH4+、Al3+、Cl-、NO3- |
| B、在由水电离出的C(H+)=1×10-12mol/L的溶液中AlO2-、HCO3-、Na+、SO42- |
| C、在使红色石蕊试纸变蓝的溶液中SO32-、CO32-、Na+、K+ |
| D、pH=1的溶液中Mg2+、Fe2+、NO3-、Cl- |
考点:离子共存问题
专题:
分析:A.离子之间相互促进水解;
B.由水电离出的C(H+)=1×10-12mol/L的溶液,为酸或碱溶液;
C.使红色石蕊试纸变蓝的溶液,显碱性;
D.pH=1的溶液,显酸性,离子之间发生氧化还原反应.
B.由水电离出的C(H+)=1×10-12mol/L的溶液,为酸或碱溶液;
C.使红色石蕊试纸变蓝的溶液,显碱性;
D.pH=1的溶液,显酸性,离子之间发生氧化还原反应.
解答:
解:A.Al3+、HCO3-离子之间相互促进水解,不能大量共存,故A错误;
B.由水电离出的C(H+)=1×10-12mol/L的溶液,为酸或碱溶液,酸性溶液中不能大量存在AlO2-、HCO3-,碱性溶液中不能大量存在HCO3-,且AlO2-促进HCO3-的电离,不能大量共存,故B错误;
C.使红色石蕊试纸变蓝的溶液,显碱性,该组离子之间不反应,可大量共存,故C正确;
D.pH=1的溶液,显酸性,H+、Fe2+、NO3-发生氧化还原反应,不能大量共存,故D错误;
故选C.
B.由水电离出的C(H+)=1×10-12mol/L的溶液,为酸或碱溶液,酸性溶液中不能大量存在AlO2-、HCO3-,碱性溶液中不能大量存在HCO3-,且AlO2-促进HCO3-的电离,不能大量共存,故B错误;
C.使红色石蕊试纸变蓝的溶液,显碱性,该组离子之间不反应,可大量共存,故C正确;
D.pH=1的溶液,显酸性,H+、Fe2+、NO3-发生氧化还原反应,不能大量共存,故D错误;
故选C.
点评:本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重氧化还原反应、水解反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
将煤处理后变为气体燃料的目的是( )
| A、提高煤的价格 |
| B、提高燃烧效率,减少大气污染 |
| C、方便存放 |
| D、方便运输 |
将一小粒钠投入氯化铜溶液中,待反应停止后,观察到的现象是( )
| A、有蓝色沉淀 |
| B、有蓝色沉淀和气体产生 |
| C、有气体产生,无沉淀生成 |
| D、无沉淀和有气体产生 |
下列说法正确的是( )
| A、KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| B、HClO是弱酸,所以NaClO是弱电解质 |
| C、HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| D、杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质 |
下列有关热化学方程式的书写及对应的表述均正确的是( )
| A、密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ?mol-1 |
| B、稀醋酸与0.1 mol?L-1 NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ?mol-1 |
| C、已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ?mol-1 |
| D、已知2C(s)+O2(g)=2CO(g)△H=-221 kJ?mol-1,则可知C的燃烧热△H=-110.5 kJ?mol-1 |
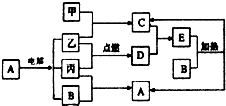 下列如框图2所示的物质转化关系中,甲、乙、丙是常见的气体单质.气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略去).
下列如框图2所示的物质转化关系中,甲、乙、丙是常见的气体单质.气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略去).