题目内容
5. 自然界存在的元素中,丰度最大的是非金属.80%以上的非金属在现代技术包括能源、功能材料等领域占有极为重要的地位.
自然界存在的元素中,丰度最大的是非金属.80%以上的非金属在现代技术包括能源、功能材料等领域占有极为重要的地位.(1)工业制硫酸中SO2转化为SO3的催化剂常用V2O5.
①写出V的基态价电子排布式3d34s2.
②反应物SO2分子中S原子的杂化轨道类型为sp2杂化.
③将催化剂V2O5加入到NaOH溶液中,可生成Na3VO4,该盐阴离子的立体构型为正四面体
(2)高温陶瓷材料Si3N4晶体中键角N-Si-N>Si-N-Si(填“>”“<”或“=”),原因是Si3N4晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N-Si-N键角为109°28′,N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大,使得Si-N-Si键角小于109°28′
(3)硼酸(H3BO3)为白色粉末状晶体,分子中非羟基氧原子数为0,则其结构式为
 .
.(4)下列物质的结构或性质与氢键有关的是abd.
a.常温常压下H2S、H2Se、H2Te都是气体,只有水以液态存在
b.DNA的双螺旋结构较稳定
c.乙醚(CH3CH2-O-CH2CH3)易挥发
d.乙醇与水以任意比互溶
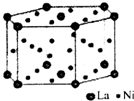
(5)储氢材料镧镍合金晶胞结构如图所示:已知镧镍合金LaNin晶胞体积为8.5×10-23cm3,储氢后形成LaNinH4.5的合金(氢进入晶胞空隙,体积不变),则LaNin中,n=5(填数值);氢在合金中的密度为0.26g•cm-3(保留两位有效数字).
分析 (1)①V元素原子核外电子数为23,位于第四周期ⅢB族;
②SO2分子中S原子的价层电子对数=2+$\frac{6-2×2}{2}$=3,杂化轨道数目为3;
③VO43-中价层电子对数为4,为正四面体结构;
(2)Si3N4晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大;
(3)H3BO3分子中非羟基氧原子数为0,则B原子连接3个-OH;
(4)a.水分子之间形成氢键;
b.DNA的双螺旋结构中存在氢键而较稳定;
c.乙醚分子之间不能形成氢键;
d.乙醇分子与水分子之间形成氢键;
(5)根据均摊法计算晶胞中La、Ni原子数目,计算二者原子数目之比可得LaNinH4.5中n的值,再结合化学式计算晶胞中H原子数目,表示出晶胞中H原子总质量,再根据ρ=$\frac{m}{V}$计算氢在合金中的密度.
解答 解:(1)①V元素原子核外电子数为23,位于第四周期ⅢB族,基态价电子排布式为3d34s2,
故答案为:3d34s2;
②SO2分子中S原子的价层电子对数=2+$\frac{6-2×2}{2}$=3,杂化轨道数目为3,S原子的杂化轨道类型为sp2杂化,
故答案为:sp2杂化;
③VO43-中价层电子对数为4,为正四面体结构;
(2)Si3N4晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N-Si-N键角为109°28′,N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大,使得Si-N-Si键角小于109°28′,
故答案为:>;Si3N4晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N-Si-N键角为109°28′,N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大,使得Si-N-Si键角小于109°28′;
(3)H3BO3分子中非羟基氧原子数为0,则B原子连接3个-OH,其结构式为: ,
,
故答案为: ;
;
(4)a.水分子之间形成氢键,常温下为液体,而H2S、H2Se、H2Te分子之间为范德华力,为气体,故a正确;
b.DNA的双螺旋结构中存在氢键而较稳定,故b正确;
c.乙醚分子之间不能形成氢键,由于范德华力较弱,易挥发,故c错误;
d.乙醇分子与水分子之间形成氢键,与水以任意比互溶,故d正确,
故选:abd;
(5)由图可知,晶胞中La原子数目为2×$\frac{1}{2}$+12×$\frac{1}{6}$=3,Ni原子数目为6+18×$\frac{1}{2}$=15,储氢后形成LaNinH4.5的合金(氢进入晶胞空隙,体积不变),故1:n=3:15,则n=5,晶胞中H原子数目为4.5×3=13.5,晶胞体积为9.5×10-23cm3,氢在合金中的密度为$\frac{13.5}{6.02×1{0}^{23}}$g÷8.5×10-23cm3=0.26g•cm-3,
故答案为:5;0.26g•cm-3.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化轨道与空间构型、价层电子对互斥理论、氢键、晶胞计算等,(4)中注意顶点原子为6个晶胞共用,利用均摊法计算解答,难度中等.

 口算题天天练系列答案
口算题天天练系列答案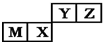
| A. | 原子半径:M>X>Y>Z | |
| B. | M的氯化物是弱电解质 | |
| C. | X的最简单气态氢化物的热稳定性比Z的小 | |
| D. | 简单离子的半径M小于Z |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(2)Ⅰ中,Fe3+产生的原因可能是 Cl- 在阳极放电,生成的 Cl2将 Fe2+氧化.写出有关反应的方程式和电极反应式2Cl--2e-=Cl2↑、Cl2+2Fe2+=2Fe3++2Cl-.
(3)由Ⅱ推测,Fe3+产生的原因还可能是 Fe2+在阳极放电,电极反应式为
(4)Ⅱ中虽未检测出 Cl2,但 Cl- 在阳极是否放电仍需进一步验证.电解 pH=1 的 NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
②与Ⅱ对比,可得出的结论:AC
A.通过控制电压,验证了 Fe2+先于 Cl- 放 电
B.电压过小,Cl- 可 能 不 放 电
C. 通过控制电压,证实了产生 Fe3+的两种原因都成立
D. 通过控制电压,证实了产生 Fe3+一定仅是由于生成的 Cl2将 Fe2+氧化.
| A. | 常温下,NaA溶液的pH=8,则c(Na+)-c(A-)=9.9×10-7 | |
| B. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>(CH3COO-) | |
| C. | 0.1mol•L-1的NaHSO3的溶液中C(Na+)>C(HSO3-)>C(H+)>C(SO32-)>C(OH-) | |
| D. | 浓度均为0.1mol/L的 CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
| A. | (SCN)2+2Br-→Br2+2SCN- | |
| B. | (SCN)2+H2S→2H++2SCN-+S↓ | |
| C. | 4H++2SCN-+MnO2 $\stackrel{△}{→}$Mn2++(SCN)2↑+2H2O | |
| D. | (SCN)2+2I-→2SCN-+I2 |
| A. | 乙烯的结构简式C2H4 | B. | 丁烷的结构简式CH3(CH2)2CH3 | ||
| C. | 四氯化碳的电子式 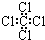 | D. | 环己烷的键线式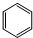 |
| A. | Na Mg Al还原性依次减弱 | B. | I2 Br2 Cl2氧化性依次增强 | ||
| C. | C N O 原子半径依次增大 | D. | P S Cl 最高正价依次升高 |
