题目内容
16.将一小块金属钠放入到盛有饱和NaOH溶液的烧杯中,观察到的现象除钠与水的反应现象外,另一明显的实验现象是沉淀产生,产生该现象的可能原因是钠与水反应消耗溶剂水,同时生成溶质氢氧化钠.分析 原溶液是饱和溶液,而钠与水反应消耗溶剂水,同时生成氢氧化钠,所以应观察到有沉淀产生,由此分析解答.
解答 解:原溶液是饱和溶液,而钠与水反应消耗溶剂水,同时生成氢氧化钠,所以应观察到有沉淀产生,
故答案为:沉淀产生;钠与水反应消耗溶剂水,同时生成溶质氢氧化钠.
点评 本题考查钠与水反应的相关知识,学生要清楚原溶液是饱和溶液,是解题的关键所在,比较容易.

练习册系列答案
相关题目
6.己知反应:①PbO2+4HCI═PbCl2+C12↑+2H20,②Cu+2Fe3+═Cu2++2Fe2+,③Cl2+2Fe2+═2Cl-+2Fe3+.则有关物质(离子)的氧化性由强到弱的顺序为( )
| A. | Cl2>Fe3+>Cu2+>PbO2 | B. | PbO2>Cl2>Fe3+>Cu2+ | ||
| C. | Fe3+>Cu2+>PbO2>Cl2 | D. | Cu2+>Fe3+>Cl2>PbO2 |
11.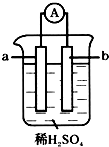 已知在金属活动性顺序表中,a为排在氢前面的金属.在如图所示的装置中,b为碳棒,关于此装置的各种叙述中,不正确的是( )
已知在金属活动性顺序表中,a为排在氢前面的金属.在如图所示的装置中,b为碳棒,关于此装置的各种叙述中,不正确的是( )
 已知在金属活动性顺序表中,a为排在氢前面的金属.在如图所示的装置中,b为碳棒,关于此装置的各种叙述中,不正确的是( )
已知在金属活动性顺序表中,a为排在氢前面的金属.在如图所示的装置中,b为碳棒,关于此装置的各种叙述中,不正确的是( )| A. | 碳棒上有气体放出,溶液酸性变弱 | B. | a是正极,b是负极 | ||
| C. | 导线中有电子从a极到b极 | D. | a极上发生了氧化反应 |
 自然界存在的元素中,丰度最大的是非金属.80%以上的非金属在现代技术包括能源、功能材料等领域占有极为重要的地位.
自然界存在的元素中,丰度最大的是非金属.80%以上的非金属在现代技术包括能源、功能材料等领域占有极为重要的地位. .
. 甲、乙、丙三种化合物均由氢、氮、氧、铜四种元素中的两种组成.常温下,甲是一种含氮质量分数为87.5%的液态化合物,其相对分子质量与空气中某种主要成分的相对分子质量相等;乙和丙是铜的两种常见氧化物,乙是新制氢氧化铜与乙醛反应的还原产物.试回答下列问题:
甲、乙、丙三种化合物均由氢、氮、氧、铜四种元素中的两种组成.常温下,甲是一种含氮质量分数为87.5%的液态化合物,其相对分子质量与空气中某种主要成分的相对分子质量相等;乙和丙是铜的两种常见氧化物,乙是新制氢氧化铜与乙醛反应的还原产物.试回答下列问题: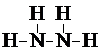 .
.