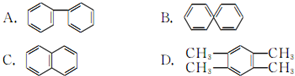题目内容
15.下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A、D为金属单质,其他为化合物.试推断:
(1)写出物质的化学式:A:AlB:Fe2O3C:Al2O3Ⅰ:Fe(OH)3.
(2)向F中逐滴滴加试剂①的现象为开始有白色沉淀生成,继续滴加沉淀溶解.
(3)写出下列反应的方程式:
C→E的离子方程式Al2O3+6H+═2Al3++3H2O
C→F的离子方程式Al2O3+2OH-═2AlO2-+H2O
G→H的离子方程式Fe2++2OH-═Fe(OH)2↓.
分析 A、D是常见的金属单质,化合物B是红色粉末,结合转化关系可知,B是Fe2O3、I为Fe(OH)3,H是Fe(OH)2,则A是Al,D为Fe、C为Al2O3,①是强酸,②是强碱(因为Al2O3溶于强碱),E中含Al3+,G中含Fe2+,F为偏铝酸盐,据此解答.
解答 解:A、D是常见的金属单质,化合物B是红色粉末,结合转化关系可知,B是Fe2O3、I为Fe(OH)3,H是Fe(OH)2,则A是Al,D为Fe、C为Al2O3,①是强酸,②是强碱(因为Al2O3溶于强碱),E中含Al3+,G中含Fe2+,F为偏铝酸盐.
(1)A为Al,B为Fe2O3,C为Al2O3,I为Fe(OH)3,
故答案为:Al;Fe2O3;Al2O3;Fe(OH)3;
(2)向F(偏铝酸盐)中逐滴滴加试剂①(强酸),开始生成氢氧化铝白色沉淀,后氢氧化铝又溶于强酸,
故答案为:开始有白色沉淀生成,继续滴加沉淀溶解;
(3)C→E的离子方程式:Al2O3+6H+═2Al3++3H2O,
C→F的离子方程式:Al2O3+2OH-═2AlO2-+H2O,
G→H的离子方程式:Fe2++2OH-═Fe(OH)2↓,
故答案为:Al2O3+6H+═2Al3++3H2O;Al2O3+2OH-═2AlO2-+H2O;Fe2++2OH-═Fe(OH)2↓.
点评 本题考查无机物推断,涉及铝和铁及其化合物的性质,物质的颜色是推断突破口,熟练掌握铝及其化合物的两性和铁及铁的化合物的氧化还原知识,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.常温下,下列各组离子,在所给条件下能够大量共存的是( )
| A. | pH=0的溶液中,Fe3+、Mg2+、Cl-、SO42- | |
| B. | 水电离出的c(H+)=1×10-10的溶液中,K+、HCO3-、Na+、S2- | |
| C. | 使pH试纸显深蓝色的溶液中,Cu2+、Fe3+、NO3-、SO42- | |
| D. | 在AlCl3溶液中:Na+、SO42-、NH4+、NO3- |
7.下列有关碱金属元素铷(Rb)的叙述中,正确的是( )
| A. | 铷与水反应的现象跟钠相似 | |
| B. | 硝酸铷易溶于水 | |
| C. | 在钠、钾、铷三种单质中,铷的熔点最高 | |
| D. | 氢氧化铷是弱碱 |
 自然界存在的元素中,丰度最大的是非金属.80%以上的非金属在现代技术包括能源、功能材料等领域占有极为重要的地位.
自然界存在的元素中,丰度最大的是非金属.80%以上的非金属在现代技术包括能源、功能材料等领域占有极为重要的地位. .
. 甲、乙、丙三种化合物均由氢、氮、氧、铜四种元素中的两种组成.常温下,甲是一种含氮质量分数为87.5%的液态化合物,其相对分子质量与空气中某种主要成分的相对分子质量相等;乙和丙是铜的两种常见氧化物,乙是新制氢氧化铜与乙醛反应的还原产物.试回答下列问题:
甲、乙、丙三种化合物均由氢、氮、氧、铜四种元素中的两种组成.常温下,甲是一种含氮质量分数为87.5%的液态化合物,其相对分子质量与空气中某种主要成分的相对分子质量相等;乙和丙是铜的两种常见氧化物,乙是新制氢氧化铜与乙醛反应的还原产物.试回答下列问题: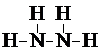 .
. 3-乙基-3-庚烯.
3-乙基-3-庚烯. 表示的分子式C6H14;一氯代物有5种.
表示的分子式C6H14;一氯代物有5种. 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基. 图中A、B、C、D是同周期或同主族的相邻元素:
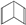
图中A、B、C、D是同周期或同主族的相邻元素: 人们对苯及芳香烃的认识有一个不断深化的过程,回答下列问题.
人们对苯及芳香烃的认识有一个不断深化的过程,回答下列问题. (Ⅱ)
(Ⅱ)