题目内容
20.下列有关离子浓度的关系不正确的是( )| A. | 常温下,NaA溶液的pH=8,则c(Na+)-c(A-)=9.9×10-7 | |
| B. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>(CH3COO-) | |
| C. | 0.1mol•L-1的NaHSO3的溶液中C(Na+)>C(HSO3-)>C(H+)>C(SO32-)>C(OH-) | |
| D. | 浓度均为0.1mol/L的 CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
分析 A.根据溶液中的电荷守恒进行计算;
B.溶液呈酸性,则c(H+)>c(OH-),结合电荷守恒判断;
C.pH=5.6的CH3COOH与CH3COONa混合溶液呈酸性,则:c(H+)>c(OH-),结合电荷守恒判断;
D.根据混合液中物料守恒和电荷守恒分析.
解答 解:A.NaA溶液中的电荷守恒:c(Na+)+c(H+)=c(A-)+c(OH-),则c(Na+)-c(A-)=c(OH-)-c(H+)=10-6mol/L-10-8mol/L=9.9×10-7mol/L,故A正确;
B.10mL O.lmol/L的CH3COOH溶液与10mL 0.lmoL/L的NaOH溶液混合,恰好生成CH3COONa,由于CH3COO-水解的程度较小,则有c(CH3COO-)>c(OH-),故B错误;
C.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(H+)>c(OH-),根据电荷守恒可知:c(Na+)<(CH3COO-),故C错误;
D.浓度均为0.1mol/L的 CH3COOH和CH3COONa溶液等体积混合,根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),根据物料守恒可得:c(CH3COO-)+c(CH3COOH)=2c(Na+),二者结合可得:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)],故D正确;
故选C.
点评 本题考查离子浓度的大小比较,题目难度中等,本题注意考虑弱电解质的电离和盐类水解的原理和应用,注意电荷守恒的应用,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
10.用石墨电极电解下列物质的水溶液,两极都有气体生成且电解过程中溶液PH增大的是( )
| A. | KI | B. | H2SO4 | C. | NaOH | D. | Na2SO4 |
11.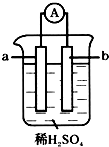 已知在金属活动性顺序表中,a为排在氢前面的金属.在如图所示的装置中,b为碳棒,关于此装置的各种叙述中,不正确的是( )
已知在金属活动性顺序表中,a为排在氢前面的金属.在如图所示的装置中,b为碳棒,关于此装置的各种叙述中,不正确的是( )
 已知在金属活动性顺序表中,a为排在氢前面的金属.在如图所示的装置中,b为碳棒,关于此装置的各种叙述中,不正确的是( )
已知在金属活动性顺序表中,a为排在氢前面的金属.在如图所示的装置中,b为碳棒,关于此装置的各种叙述中,不正确的是( )| A. | 碳棒上有气体放出,溶液酸性变弱 | B. | a是正极,b是负极 | ||
| C. | 导线中有电子从a极到b极 | D. | a极上发生了氧化反应 |
15.下列物质属于离子化合物的是( )
| A. | HCl | B. | NH3•H2O | C. | (NH4)2SO4 | D. | CH3COOH |
12. 碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.
碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.
(1)石墨烯是一种由碳原子构成的单层片状结构的新材料,结构如右图所示.则12g石墨烯中含有0.5NA个6元环.
(2)工业上利用甲烷和氧气直接氧化制取甲醇的反应如下:
CH4+$\frac{1}{2}$O2(g)?CH3OH(g)△H=-128.5kJ/mol
副反应有:CH4(g)+$\frac{3}{2}$O2(g)?CO(g)+2H2O(g)△H=a kJ/mol
CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H=b kJ/mol
CH4(g)+O2(g)→HCHO(g)+H2O(g)△H=c kJ/mol
①若要有利于甲醇的生成,除了改变温度外,还可以采取的两种措施是增大压强、选用合适的催化剂;
②甲醇与氧气反应生成HCHO(g)和水蒸汽的热化学方程式为CH3OH(g)+$\frac{1}{2}$O2(g)→HCHO(g)+H2O(g)△H=(c+128.5)KJ•L-1.
(3)苯乙烷(C8H10)生产苯乙烯(C8H8)的反应:C8H10(g)?C8H8(g)+H2(g)△H>0.T1℃下,将0.40mol苯乙烷充入2L密闭容器中反应,不同时间容器内n(C8H10)如下表:
2当反应进行到30min时恰好到达平衡,则n2取值的最小范围是0.22<n<0.26;
②改变温度为T2℃,其他条件不变,测得平衡时容器内气体压强为反应前的1.4倍,则此时苯乙烷的转化率为40%.
(4)用惰性电极电解葡萄糖和硫酸钠混合溶,可以制得葡萄糖酸[CH2OH(CHOH)4COOH]和己六醇[CH2OH(CHOH)4CH2OH].葡萄糖酸在阳极生成,对应的电极反应式CH2OH(CHOH)4CHO+H2O-2e-═CH2OH(CHOH)4COOH+2H+.
 碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.
碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.(1)石墨烯是一种由碳原子构成的单层片状结构的新材料,结构如右图所示.则12g石墨烯中含有0.5NA个6元环.
(2)工业上利用甲烷和氧气直接氧化制取甲醇的反应如下:
CH4+$\frac{1}{2}$O2(g)?CH3OH(g)△H=-128.5kJ/mol
副反应有:CH4(g)+$\frac{3}{2}$O2(g)?CO(g)+2H2O(g)△H=a kJ/mol
CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H=b kJ/mol
CH4(g)+O2(g)→HCHO(g)+H2O(g)△H=c kJ/mol
①若要有利于甲醇的生成,除了改变温度外,还可以采取的两种措施是增大压强、选用合适的催化剂;
②甲醇与氧气反应生成HCHO(g)和水蒸汽的热化学方程式为CH3OH(g)+$\frac{1}{2}$O2(g)→HCHO(g)+H2O(g)△H=(c+128.5)KJ•L-1.
(3)苯乙烷(C8H10)生产苯乙烯(C8H8)的反应:C8H10(g)?C8H8(g)+H2(g)△H>0.T1℃下,将0.40mol苯乙烷充入2L密闭容器中反应,不同时间容器内n(C8H10)如下表:
| 时间/min | 0 | 10 | 20 | 30 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 |
②改变温度为T2℃,其他条件不变,测得平衡时容器内气体压强为反应前的1.4倍,则此时苯乙烷的转化率为40%.
(4)用惰性电极电解葡萄糖和硫酸钠混合溶,可以制得葡萄糖酸[CH2OH(CHOH)4COOH]和己六醇[CH2OH(CHOH)4CH2OH].葡萄糖酸在阳极生成,对应的电极反应式CH2OH(CHOH)4CHO+H2O-2e-═CH2OH(CHOH)4COOH+2H+.
9.已知 ,下列叙述错误的是( )
,下列叙述错误的是( )
 ,下列叙述错误的是( )
,下列叙述错误的是( )| A. | 反应①和②互为可逆反应 | |
| B. | 反应①中I2既作氧化剂又作还原剂 | |
| C. | 反应②中IO3-作氧化剂 | |
| D. | 检验加碘盐中的KIO3可用淀粉KI溶液和食醋 |
10.常温下,下列各组离子,在所给条件下能够大量共存的是( )
| A. | pH=0的溶液中,Fe3+、Mg2+、Cl-、SO42- | |
| B. | 水电离出的c(H+)=1×10-10的溶液中,K+、HCO3-、Na+、S2- | |
| C. | 使pH试纸显深蓝色的溶液中,Cu2+、Fe3+、NO3-、SO42- | |
| D. | 在AlCl3溶液中:Na+、SO42-、NH4+、NO3- |
 自然界存在的元素中,丰度最大的是非金属.80%以上的非金属在现代技术包括能源、功能材料等领域占有极为重要的地位.
自然界存在的元素中,丰度最大的是非金属.80%以上的非金属在现代技术包括能源、功能材料等领域占有极为重要的地位. .
.