题目内容
13.用 FeCl3酸性溶液脱除 H2S 后的废液,通过控制电压电解得以再生.某同学使用石墨电极,在不同电压(x)下电解 pH=1 的 0.1mol/L FeCl2溶液,研究废液再生机理.记录如下(a、b、c代表电压值:)| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(2)Ⅰ中,Fe3+产生的原因可能是 Cl- 在阳极放电,生成的 Cl2将 Fe2+氧化.写出有关反应的方程式和电极反应式2Cl--2e-=Cl2↑、Cl2+2Fe2+=2Fe3++2Cl-.
(3)由Ⅱ推测,Fe3+产生的原因还可能是 Fe2+在阳极放电,电极反应式为
(4)Ⅱ中虽未检测出 Cl2,但 Cl- 在阳极是否放电仍需进一步验证.电解 pH=1 的 NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
②与Ⅱ对比,可得出的结论:AC
A.通过控制电压,验证了 Fe2+先于 Cl- 放 电
B.电压过小,Cl- 可 能 不 放 电
C. 通过控制电压,证实了产生 Fe3+的两种原因都成立
D. 通过控制电压,证实了产生 Fe3+一定仅是由于生成的 Cl2将 Fe2+氧化.
分析 (1)依据铁离子的检验方法和试剂颜色变化分析;
(2)依据电解原理,氯离子在阳极失电子生成氯气,氯气具有氧化性氧化亚铁离子生成铁离子溶液变黄色;
(3)Fe3+产生的原因还可能是Fe2+在阳极放电,依据氧化还原反应分析Fe2+具有还原性;
(4)①电解pH=1的0.1mol/L FeCl2溶液,电解pH=1的NaCl溶液做对照试验,探究氯离子是否放电,需要在难度相同的条件下进行分析判断;
②依据图表数据比较可知,电解pH=1的NaCl溶液做对照试验与Ⅱ对比,通过控制电压证明了亚铁离子还原性大于氯离子优先放电,生成铁离子的两种可能.
解答 解:(1)检验铁离子的试剂是硫氰酸钾溶液,用KSCN溶液检测处Fe3+的现象是溶液变红色,故答案为:溶液变红;
(2)依据电解原理,氯离子在阳极失电子生成氯气,电极反应为:2Cl--2e-=Cl2↑,氯气具有氧化性氧化亚铁离子生成铁离子溶液变黄色,反应的离子方程式为:Cl2+2Fe2+=2Fe3++2Cl-;
故答案为:2Cl--2e-=Cl2↑,Cl2+2Fe2+=2Fe3++2Cl-;
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,元素化合价升高,依据氧化还原反应分析Fe2+具有还原性,即Fe2+-2e-=Fe3+,故答案为:Fe2+-2e-=Fe3+;
(4)①电解pH=1的0.1mol/L FeCl2溶液,电解pH=1的NaCl溶液做对照试验,探究氯离子是否放电,需要在难度相同的条件下进行,所以氯化钠溶液的浓度为0.2mol/L,故答案为:0.2;
②依据图表数据比较可知,电解pH=1的NaCl溶液做对照试验与Ⅱ对比,通过控制电压证明了亚铁离子还原性大于氯离子优先放电,说明生成铁离子的两种可能,一是二价铁失电子变成三价铁,二是氯离子失电子变成氯气,氯气再氧化二价铁变成三价铁.对于补充的那个实验,实验四的电压高,氯气放电,实验五电压低,氯气不放电,而实验二氯气皆放电;
故答案为:AC.
点评 本题考查了离子检验方法和现象分析,电解原理的分析应用,电解反应,电极产物的理解应用,掌握基础是关键,题目难度中等.

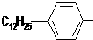
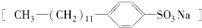 是常用洗涤剂的主要成分.其结构可用图形
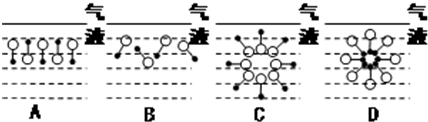
是常用洗涤剂的主要成分.其结构可用图形 来表示,•端为链烃基,O端为极性基.根据这一结构特点,试分析和回答下列问题:
来表示,•端为链烃基,O端为极性基.根据这一结构特点,试分析和回答下列问题: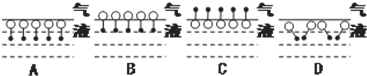
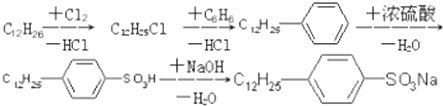
 .
.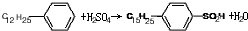 ,反应类型为取代反应.
,反应类型为取代反应.

 自然界存在的元素中,丰度最大的是非金属.80%以上的非金属在现代技术包括能源、功能材料等领域占有极为重要的地位.
自然界存在的元素中,丰度最大的是非金属.80%以上的非金属在现代技术包括能源、功能材料等领域占有极为重要的地位. .
.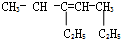 3-乙基-3-庚烯.
3-乙基-3-庚烯.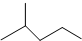 表示的分子式C6H14;一氯代物有5种.
表示的分子式C6H14;一氯代物有5种.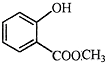 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.