题目内容
16.日本的核泄漏引起了人们对核能的恐慌,也加剧了人类对化石燃料的依赖,化石燃料特别是煤的使用不当会加剧环境污染,工业上常把煤进行汽化、液化处理,使煤变成清洁能源.煤的一种转化流程图如下: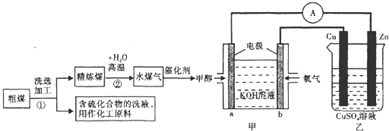
(1)随着反应的进行,乙池的电解质溶液的pH不变(填“增大、减小、不变”);甲池中负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
(2)已知在常温常压下:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1451.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol.则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H═-442.8kJ/mol
(3)C(s)和H2O(g)在一定条件下反应可得一H2等清洁燃料.将不同量的C(s)和H2O(g)分别加入到体积为2L的恒容密闭容器中发生反应:C(s)+H2O(g)?CO(g)+H2(g),不同温度下得到三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| C | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | … | 6 |
| 2 | 900 | 6 | 3 | … | 1.5 | 3 |
| 3 | 900 | … | … | … | … | 1 |
②若实验3起始时充入的是CO(g)和H2(g),且达平衡时实验2、3中CO的体积分数相同,则起始时c(H2)=1.5mol/L.
分析 (1)甲池为原电池,负极通入甲醇,发生氧化反应,在碱性条件下生成碳酸根离子和水;
池为原电池,与电源正极相连的铜为阳极,铜失去电子发生氧化反应;锌为阴极,铜离子得到电子反应还原反应,依此进行解答;
(2)根据盖斯定律,由(①-②)÷2得出正确结论;
(3)①根据平衡时各物质的浓度,结合平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;
减小压强,平衡向着气体体积增大的方向移动,依此进行判断;
②根据等效平衡进行判断.恒容密闭容器,转到一边,实验2、3的起始投料量相等.
解答 解:(1)甲池为原电池,负极通入甲醇,发生氧化反应,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O;
乙池为原电池,与电源正极相连的铜为阳极,发生氧化反应,电极反应式为:Cu-2e-═Cu2+,锌为阴极,发生还原反应,电极反应式为:Cu2++2e-=Cu,故的电解质溶液的pH不变,
故答案为:不变;CH3OH-6e-+8OH-=CO32-+6H2O;
(2)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O△H=-1451.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
由(①-②)÷2得,CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=$\frac{(-1451.6kJ/mol)-(-566kJ/mol)}{2}$=-442.8kJ/mol,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H═-442.8kJ/mol;
(3)①实验2中达到平衡时,c(CO)=c(H2)=$\frac{1.5mol}{2L}$=0.75mol/L,c(H2O)=$\frac{3mol-1.5mol}{2L}$=0.75mol/L,
K=$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$=$\frac{0.75×0.75}{0.75}$=0.75;
实验2中分离出1molH2O(g),则体系压强减小,平衡正向移动,H2O(g)的转化率增大,
故答案为:0.75;增大;
(3)实验3起始时充入的是CO(g)和H2(g),且达平衡时实验2、3中CO的体积分数相同,说明两者为等效平衡,且为恒容密闭容器,故转到一边,实验2、3的起始投料量相等.实验2的起始投料为3molH2O,全部转到右边,相当于3molCO和3molH2,故实验3起始时应加入3molCO和3molH2,故c(H2)=$\frac{3mol}{2L}$=1.5mol/L,
故答案为:1.5mol/L.
点评 本题考查较为综合,涉及原电池和电解池的电极反应式的书写、盖斯定律的应用、平衡常数的计算、及等效平衡等知识,为高考常见题型,侧重于学生的分析能力和实验能力的考查,综合性较强,难度较大.

 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案| A. | 油脂是高级脂肪酸和甘油生成的酯 | |
| B. | 米饭在嘴中越咀嚼越甜的原因是淀粉水解生成甜味物质 | |
| C. | 油脂、乙醇是人体必需的营养物质 | |
| D. | 水果因含有酯类物质而具有香味 |
| 银盐 性质 | AgCl | AgBr | Ag2CrO4 |
| 颜色 | 白 | 浅黄 | 砖红 |
| A. | 配制NaOH标准液时,所用的NaOH固体中含有少量的KOH杂质 | |
| B. | 滴定前对碱式滴定管仰视读数,滴定后又俯视 | |
| C. | 滴定前,碱式滴定管尖嘴部分有气泡,滴定后气泡消失 | |
| D. | 碱式滴定管用蒸馏水洗净后,直接装入标准NaOH溶液 |
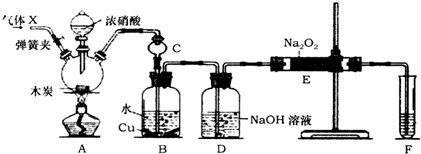
已知:①3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;②酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+.
具体操作:如图连接装置,检验气密性后,装入药品.实验开始前先通入常见气体X一段时间,然后关闭弹簧夹,再滴加浓硝酸,加热控制B中导管均匀地产生气泡,直至E中淡黄色粉末完全变为白色固体.
(1)气体X的化学式为N2,其作用是排尽系统内空气,以免生成的一氧化氮被空气中的氧气氧化.
(2)上述装置中,仪器C的作用是防止B中溶液倒吸.B中观察到的主要现象是铜片减小、溶液变蓝色、有气泡冒出.
(3)该活动小组制取的NaNO2产品不纯,杂质为NaOH(填化学式);为提高产品的纯度,对上述实验装置进行的改进是装置DE之间和装置EF之间添加干燥装置.
(4)请设计实验证明产品中含有NO2-取少量E中白色固体加入稀盐酸产生无色气体,遇到空气变化为红棕色证明固体中含有亚硝酸根离子(简述实验操作、现象和结论).
(5)称取该小组产品4.5g溶于水配成500mL溶液,取50mL溶液于锥形瓶中,用0.1000mol•L-1的酸性KMnO4溶液进行滴定,实验数据如表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.80 | 20.01 | 20.00 | 19.99 |
a.酸式滴定管未用标准液润洗
b.锥形瓶用水洗净后又用待测液润洗
c.滴定前仰视读数,滴定终点平视读数
d.滴定结束后滴定管尖嘴处仍悬有液滴
根据表中数据,计算产品中亚硝酸钠的质量分数76.7%.
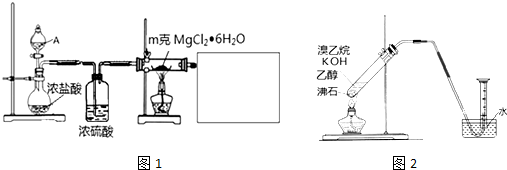
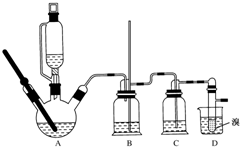 用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)有乙醇制备1,2-二溴乙烷的两个方程式:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O、CH2=CH2+Br-Br→CH2Br-CH2Br
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置C中应加入c(填序号),其目的是吸收反应中可能生成的酸性气体.
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”“下”);
(5)安全瓶B中加入水,可以防倒吸,还可以检查反应进行时后面装置是否发生堵塞,写出发生堵塞时瓶B中现象:B中水面会下降,玻璃管中的水柱会上升,甚至溢出.
(6)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(7)若产物中有少量副产物乙醚,可用蒸馏的方法除去.
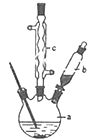 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一,下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一,下面是它的一种实验室合成路线: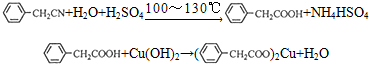
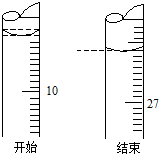 某学生欲用已知物质的量浓度的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白: