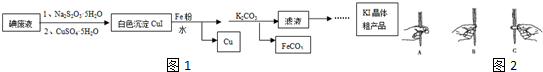
题目内容
7.莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度.已知:| 银盐 性质 | AgCl | AgBr | Ag2CrO4 |
| 颜色 | 白 | 浅黄 | 砖红 |
分析 以K2CrO4为指示剂,生成Ag2CrO4为砖红色,用标准硝酸银滴定待测液,滴定终点的现象是滴入最后一滴标准溶液,生成砖红色沉淀且30s内不褪色;
根据Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O,I2+2S2O32-═2I-+S4O62-得关系式Cr2O72-----6S2O32-,
再由Cr2O72-和6S2O32-的关系式计算Cr2O72-的物质的量,根据原子守恒计算(NH4)2Cr2O7的质量,再根据质量分数公式计算其质量分数即可.
解答 解:以K2CrO4为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度,则滴入最后一滴硝酸银溶液时,溶液中出现砖红色铬酸银沉淀,并且30s内不褪色即为终点,反应的离子方程式为:2Ag++CrO42-=Ag2CrO4↓;
根据Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O,I2+2S2O32-═2I-+S4O62-得关系式Cr2O72-----6S2O32-,
设Cr2O72-的物质的量为x,
Cr2O72-----6S2O32-,
1 6
x 0.1000mol/L×0.03L
1:6=x:(0.1000mol/L×0.03L)
x=0.0005mol,
根据原子守恒得n(Cr2O72-)=n((NH4)2Cr2O7),则m((NH4)2Cr2O7)=0.0005mol×252g/mol=0.126g,
其质量分数=$\frac{0.126g}{0.150g}$×100%=84%,
故答案为:滴入最后一滴标准液时,生成砖红色沉淀,且30s内不褪色;2Ag++CrO42-=Ag2CrO4↓;84%.
点评 本题考查滴定的基本操作依据相关计算,难度中等,注意理解滴定的原理与操作.

| A. | 同一物质的固、液、气三种状态的熵值相同 | |
| B. | NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g);△H=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 焓变或熵变均可以单独作为反应自发性的判据 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
| A. | 标准状态下,33.6L三氧化硫中含有硫原子的数目为1.5 NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5 NA | |
| C. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46 NA | |
| D. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1 NA |
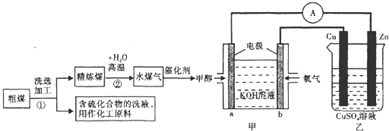
(1)随着反应的进行,乙池的电解质溶液的pH不变(填“增大、减小、不变”);甲池中负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
(2)已知在常温常压下:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1451.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol.则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H═-442.8kJ/mol
(3)C(s)和H2O(g)在一定条件下反应可得一H2等清洁燃料.将不同量的C(s)和H2O(g)分别加入到体积为2L的恒容密闭容器中发生反应:C(s)+H2O(g)?CO(g)+H2(g),不同温度下得到三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| C | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | … | 6 |
| 2 | 900 | 6 | 3 | … | 1.5 | 3 |
| 3 | 900 | … | … | … | … | 1 |
②若实验3起始时充入的是CO(g)和H2(g),且达平衡时实验2、3中CO的体积分数相同,则起始时c(H2)=1.5mol/L.
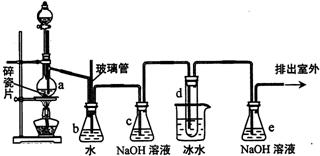
已知:
CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O
CH3CH2OH$→_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O
相关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
| 密度(g/mL) | 0.79 | 2.18 | 0.71 | 3.10 |
| 沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
| 熔点/℃ | -114.3 | 9.79 | -116.2 | -7.2 |
| 水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(2)安全瓶b在实验中有多重作用.其一可以检查实验进行中导管d是否发生堵塞,请写出发生堵塞时瓶b中的现象玻璃管中的液面上升,锥形瓶中的液面下降;
安全瓶b还可以起到的作用是防止倒吸.
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是吸收乙烯气体中含有的CO2、SO2等酸性气体.
(4)除去产物中少量未反应的Br2后,还含有的主要杂质为乙醚,要进一步提纯,下列操作中必须的是D(填入正确选项前的字母);
A.重结晶 B.过滤 C.萃取 D.蒸馏
(5)实验中也可以撤去d装置中盛冰水的烧杯,改为将冷水直接加入到d装置的试管内,则此时冷水除了能起到冷却1,2一二溴乙烷的作用外,还可以起到的作用是液封Br2及1,2-二溴乙烷.
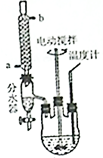 某学习小组以乙二酸(分子式:H2C2O4,结构简式:HOOC-COOH,二元弱酸,俗称草酸)和乙醇为原料制备乙二酸二乙酯,实验步骤如下:
某学习小组以乙二酸(分子式:H2C2O4,结构简式:HOOC-COOH,二元弱酸,俗称草酸)和乙醇为原料制备乙二酸二乙酯,实验步骤如下: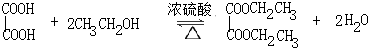 .
.