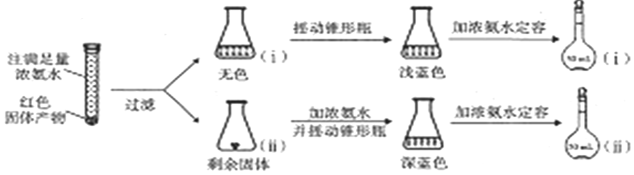
题目内容
2.已知反应 2H2S+SO2═3S+2H2O当转移2mol电子时,氧化产物比还原产物质量多16g.分析 在SO2+2H2S=2H2O+3S↓反应中,SO2中S元素的化合价由+4降低为0,H2S中S元素的化合价由-2升高到0,以此来解答.
解答 解:在SO2+2H2S=2H2O+3S↓反应中,SO2中S元素的化合价由+4降低为0,为氧化剂;H2S中S元素的化合价由-2升高到0,为还原剂,则S单质既是氧化产物又是还原产物,
当有2mol电子发生转移时,生成1.5molS,即氧化产物和还原产物的和为1.5mol,其中H2S被氧化生成的S为1mol,SO2被还原生成的S为0.5mol,则氧化产物比还原产物多0.5mol,即16g;
故答案为:16.
点评 本题考查氧化还原反应,题目难度不大,注意从氧化化合价的角度认识氧化还原反应的相关概念和相关物质的性质,答题时注意题给信息为解答该题的关键.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
12.X(s)+3Y(g)?Z(g)△H=-a kJ•mol-1,一定条件下,将2mol X和2mol Y通入2L的恒容密闭容器中,反应10s,测得生成0.5molZ.下列说法正确的是( )
| A. | 10s内,X的平均反应速率为0.025 mol•L-1•s-1 | |
| B. | 第10s时,Y的反应速率为0.075 mol•L-1•s-1 | |
| C. | 第10s时,X为 1.5 mol,Y的浓度为0.25 mol•L-1 | |
| D. | 10s内,X和Y反应放出的热量为a kJ |
13.化学无处不在,下列用品的有效成分及用途对应错误的是( )
| A. | 食盐既可以做调味剂,又可以做防腐剂 | |
| B. | 纯碱既可以做清洗品,又可以做发酵粉 | |
| C. | 漂白粉既可以做消毒剂,又可以做漂白剂 | |
| D. | 酒精既可以做饮料,又可以做燃料 |
10.下列解释实验现象的方程式不正确的是( )
| A. | 漂白粉或漂粉精长期暴露在空气中会变质:Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO 2HClO=2 HCl+O2↑ | |
| B. | FeCl3溶液中加入铁粉,震荡后滴入几滴KSCN溶液,未见溶液变红:2Fe3++Fe═3 Fe2+ | |
| C. | 把水加入盛有过氧化钠固体的试管中,放出气体,可使带火星的木条复燃:2Na2O2+2 H2O═4 NaOH+O2↑ | |
| D. | 溶质物质的量之比为1:2的明矾溶液与 Ba(OH)2溶液混合,生成白色沉淀:Al3++2SO42-+2Ba2++4 OH-═2 BaSO4↓+Al(OH)3↓+H2O |
17.已知有如下反应:
①2BrO3-+Cl2═Br2+2ClO3-,
②ClO3-+5Cl-+6H+═3Cl2↑+3H2O,
③3Cl2+I2+6H2O=2HIO3+10HCl.
下列各微粒氧化能力由强到弱的顺序正确的是( )
①2BrO3-+Cl2═Br2+2ClO3-,
②ClO3-+5Cl-+6H+═3Cl2↑+3H2O,
③3Cl2+I2+6H2O=2HIO3+10HCl.
下列各微粒氧化能力由强到弱的顺序正确的是( )
| A. | Cl2>BrO3->ClO3->HIO3 | B. | ClO3->BrO3->HIO3>Cl2 | ||
| C. | BrO3->Cl2>ClO3->HIO3 | D. | BrO3->ClO3->Cl2>HIO3 |
15.已知H2(g)、CO(g)、CH3OH(l)的燃烧热△H分别是-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.下列有关叙述正确的是( )
| A. | 甲醇不完全燃烧生成CO和液态水的热化学方程式:CH3OH(l)+O2 (g)═CO(g)+2H2O(l)△H1=-1009.5kJ•mol-1 | |
| B. | CH3OH(l)+$\frac{1}{2}$O2 (g)═CO2(g)+2H2 (g)△H1=-440.7kJ•mol-1 | |
| C. | 2H2O(g)═2H2(g)+O2(g)△H1=+571.6 kJ•mol-1 | |
| D. | 已知:S(s)+O2(g)═SO2(g)△H1;S(g)+O2(g)=SO2(g)△H2;则△H1>△H2 |
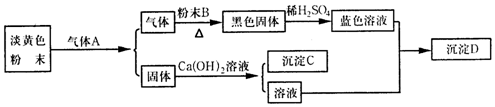
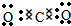 .
.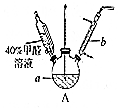 甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发.为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究.
甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发.为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究.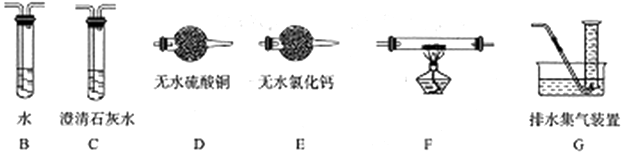
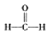 $\stackrel{被氧化}{→}$
$\stackrel{被氧化}{→}$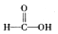 $\stackrel{被氧化}{→}$
$\stackrel{被氧化}{→}$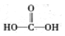 .设计实验证明a中甲醛的碳元素未被氧化成+4价.
.设计实验证明a中甲醛的碳元素未被氧化成+4价.