题目内容
12.X(s)+3Y(g)?Z(g)△H=-a kJ•mol-1,一定条件下,将2mol X和2mol Y通入2L的恒容密闭容器中,反应10s,测得生成0.5molZ.下列说法正确的是( )| A. | 10s内,X的平均反应速率为0.025 mol•L-1•s-1 | |
| B. | 第10s时,Y的反应速率为0.075 mol•L-1•s-1 | |
| C. | 第10s时,X为 1.5 mol,Y的浓度为0.25 mol•L-1 | |
| D. | 10s内,X和Y反应放出的热量为a kJ |
分析 反应10s,测得生成0.5molZ,根据反应X(g)+3Y(g)?2Z(g)可知,10s内消耗0.5molX、1.5molY,
A.根据v=$\frac{\frac{△n}{V}}{△t}$计算出10s内X的平均反应速率;
B.无法计算第10s时Y的反应速率;
C.根据反应消耗X、Y的物质的量计算出10s时二者物质的量及Y的浓度;
D.根据反应生成Z的物质的量计算出放热热量.
解答 解:反应10s,测得生成0.5molZ,根据反应X(g)+3Y(g)?2Z(g)可知,10s内消耗0.5molX、1.5molY,
A.10s内,X的平均反应速率为:$\frac{\frac{0.5mol}{2L}}{10s}$=0.025mol•L-1•s-1,故A正确;
B.化学反应速率与化学计量数成正比,则10s内Y的反应速率为:v(Y)=3v(X)=0.075mol•L-1•min-1,该速率为平均速率,无法计算及时速率,故B错误;
C.根据分析可知,10s内,10s内消耗0.5molX、1.5molY,则第10s时X的物质的量为:2mol-0.5mol=1.5 mol,Y的浓度为:$\frac{2mol-1.5mol}{10L}$=0.05 mol•L-1,故C错误;
D.10s时生成0.5molZ,则放出的热量为:akJ/mol×0.5mol=0.5akJ,故D错误;
故选A.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学反应速率的概念及表达式为解答关键,注意掌握化学平衡及其影响,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | 乙烯和乙烷都能发生加聚反应 | |
| B. | 乙烯和苯都能与溴水反应 | |
| C. | 乙醇不能发生取代反应 | |
| D. | 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 |
7.下列有关说法正确的是( )
| A. | 反应2CO(g)=2C(s)+O2(g)△H>0可以自发进行 | |
| B. | 放热反应在常温条件下一定很容易进行 | |
| C. | 平衡常数发生变化,化学平衡一定发生移动 | |
| D. | 化学平衡发生移动,平衡常数一定发生改变 |
17.下列说法正确的是( )
| A. | H2SO4和H3PO4的摩尔质量相等 | |
| B. | 2g氢气中含有1 mol氢 | |
| C. | O2的摩尔质量在数值上等于其一个分子的质量 | |
| D. | 1 mol CO的质量是28 g•mol-1 |
4.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | 0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-) | |
| D. | c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl) |
1.只含有一种元素的物质( )
| A. | 可能是纯净物也可能是混合物 | B. | 一定是一种化合物 | ||
| C. | 一定是纯净物 | D. | 一定是一种单质 |
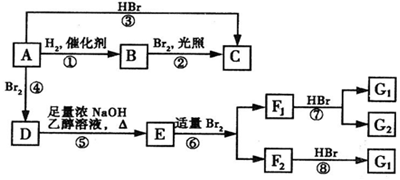
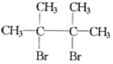 ,F1和F2互为同分异构体,G1和G2互为同分异构体.)
,F1和F2互为同分异构体,G1和G2互为同分异构体.)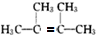 .
.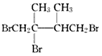 .
.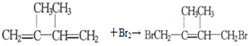 .
.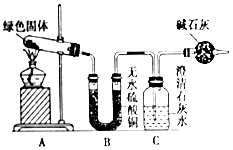 铜器久置,表面会生成一层绿色固体,某化学兴趣小组收集家中铜器表面的绿色固体进行探究.查阅相关资料后,得知该绿色物质是碱式碳酸铜.该小组同学利用如图装置进行实验,探究碱式碳酸铜的分解产物.
铜器久置,表面会生成一层绿色固体,某化学兴趣小组收集家中铜器表面的绿色固体进行探究.查阅相关资料后,得知该绿色物质是碱式碳酸铜.该小组同学利用如图装置进行实验,探究碱式碳酸铜的分解产物.