题目内容
13.化学无处不在,下列用品的有效成分及用途对应错误的是( )| A. | 食盐既可以做调味剂,又可以做防腐剂 | |
| B. | 纯碱既可以做清洗品,又可以做发酵粉 | |
| C. | 漂白粉既可以做消毒剂,又可以做漂白剂 | |
| D. | 酒精既可以做饮料,又可以做燃料 |
分析 A.食盐它可以使细菌细胞脱水死亡,所以可以杀菌;
B.纯碱性质稳定受热不分解;
C.次氯酸钠具有强氧化性,能杀菌消毒,且具有漂白性;
D.乙醇具有特殊香味,能够燃烧.
解答 解:A.食盐它可以使细菌细胞脱水死亡,所以可以杀菌,可作为防腐剂,食盐具有咸味是咸味剂,故A正确;
B.纯碱性质稳定受热不分解,碳酸氢钠不稳定受热分解生成二氧化碳,可以做发酵粉,故B错误;
C.漂白粉次氯酸根离子具有强的氧化性,具有漂白性和杀菌消毒作用,既可以做消毒剂,又可以做漂白剂,故C正确;
D.乙醇具有特殊香味,能够燃烧,所以酒精既可以做饮料,又可以做燃料,故D正确;
故选:B.
点评 本题考查了元素化合物知识,侧重考查物质的用途,明确相关物质的性质是解题关键,注意对相关知识的积累,题目难度中等.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
4.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | 0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-) | |
| D. | c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl) |
1.只含有一种元素的物质( )
| A. | 可能是纯净物也可能是混合物 | B. | 一定是一种化合物 | ||
| C. | 一定是纯净物 | D. | 一定是一种单质 |
8.下列叙述正确的是( )
| A. | 某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | |
| B. | 在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液pH<7 | |
| C. | 若1mL pH=1的盐酸与100mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 | |
| D. | 1.0×10-3mol•L-1盐酸的pH=3.0;1.0×10-8mol•L-1盐酸的pH=8.0 |
3.某兴趣小组制备氢氧化亚铁沉淀.
(1)实验1中产生白色沉淀的离子方程式是Fe2++2OH-=Fe(OH)2↓.
(2)为了探究沉淀变灰绿色的原因,该小组同学展开如下探究:
①甲同学推测灰绿色物质为Fe(OH)2和Fe(OH)3混合物.查阅资料后根据调色原理认为白色和红褐色的调和色不可能是灰绿色,并设计实验证实灰绿色物质中不含有Fe(OH)3,方案是取一定量的灰绿色沉淀,加入盐酸溶解,再加入KSCN溶液,若溶液不变红色,则证明灰绿色物质中不含有Fe(OH)3.
②乙同学查阅文献:Fe(OH)2在大量SO42-存在的情况下形成Fe6(SO4)2(OH)4O3(一种氧基碱式复盐).并设计对比实验证实该假设:向试管中加入2mL0.1mol/LFeCl2溶液,再往试管中加入3滴0.1mol/LNaOH溶液,振荡,现象与实验1相同,结论是该假设不成立.
③乙同学继续查阅文献:Fe(OH)2沉淀具有较强的吸附性能,灰绿色可能是由Fe(OH)2表面吸附Fe2+引起.推测所用的硫酸亚铁溶液的浓度应越小越好;氢氧化钠溶液浓度应越大越好.设计了如下实验方案:
该实验得出的结论是在氢氧化钠溶液浓度一定的条件下,硫酸亚铁溶液的浓度越小,产生白色沉淀的现象越明显,能说明灰绿色是由Fe(OH)2表面吸附Fe2+引起的证据是实验2中沉淀下沉后,大部分灰绿色变为白色沉淀(或实验3中沉淀下沉后,底部都为白色沉淀).丙同学认为该实验方案不足以证明灰绿色是由Fe(OH)2表面吸附Fe2+引起的,还需补充的实验是向实验2(或实验3)的白色沉淀中继续加入过量的硫酸亚铁溶液,白色沉淀变成灰绿色,证明该假设成立.
(3)丙同学探究温度对氢氧化亚铁制备实验的影响:取少量灰绿色沉淀,在水浴中加热,颜色由灰绿变白,且有絮状白色沉淀下沉,原因为Fe2+在加热时易发生水解,生成Fe(OH)2,因此颜色变白,同时沉淀的量增加,导致出现絮状白色沉淀.
(4)根据以上实验探究,若尽可能制得白色Fe(OH)2沉淀,需要控制的实验条件隔绝氧气、硫酸亚铁少量(或氢氧化钠过量)、硫酸亚铁浓度小(或氢氧化钠浓度大)、将氢氧化钠溶液逐滴加入到硫酸亚铁溶液中、微热等.
| 实验1 | 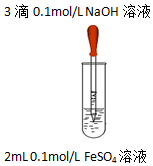 | 实验现象 |
| 液面上方产生白色絮状沉淀,迅速变为灰绿色,振荡,试管壁上有红褐色沉淀生成. |
(2)为了探究沉淀变灰绿色的原因,该小组同学展开如下探究:
①甲同学推测灰绿色物质为Fe(OH)2和Fe(OH)3混合物.查阅资料后根据调色原理认为白色和红褐色的调和色不可能是灰绿色,并设计实验证实灰绿色物质中不含有Fe(OH)3,方案是取一定量的灰绿色沉淀,加入盐酸溶解,再加入KSCN溶液,若溶液不变红色,则证明灰绿色物质中不含有Fe(OH)3.
②乙同学查阅文献:Fe(OH)2在大量SO42-存在的情况下形成Fe6(SO4)2(OH)4O3(一种氧基碱式复盐).并设计对比实验证实该假设:向试管中加入2mL0.1mol/LFeCl2溶液,再往试管中加入3滴0.1mol/LNaOH溶液,振荡,现象与实验1相同,结论是该假设不成立.
③乙同学继续查阅文献:Fe(OH)2沉淀具有较强的吸附性能,灰绿色可能是由Fe(OH)2表面吸附Fe2+引起.推测所用的硫酸亚铁溶液的浓度应越小越好;氢氧化钠溶液浓度应越大越好.设计了如下实验方案:
| 试管中10mL NaOH溶液 | 滴加 FeSO4溶液 | 实验现象 | |
| 实验2 | 6mol/L NaOH溶液 | 0.2mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有少量灰绿色),沉淀下沉后,大部分灰绿色变为白色沉淀 |
| 实验3 | 6mol/L NaOH溶液 | 0.1mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有极少量灰绿色),沉淀下沉后,底部都为白色沉淀 |
(3)丙同学探究温度对氢氧化亚铁制备实验的影响:取少量灰绿色沉淀,在水浴中加热,颜色由灰绿变白,且有絮状白色沉淀下沉,原因为Fe2+在加热时易发生水解,生成Fe(OH)2,因此颜色变白,同时沉淀的量增加,导致出现絮状白色沉淀.
(4)根据以上实验探究,若尽可能制得白色Fe(OH)2沉淀,需要控制的实验条件隔绝氧气、硫酸亚铁少量(或氢氧化钠过量)、硫酸亚铁浓度小(或氢氧化钠浓度大)、将氢氧化钠溶液逐滴加入到硫酸亚铁溶液中、微热等.
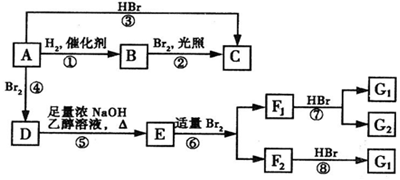
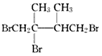
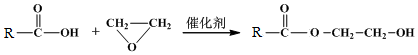
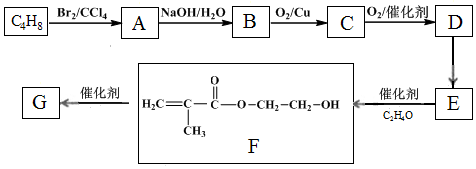
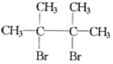 ,F1和F2互为同分异构体,G1和G2互为同分异构体.)
,F1和F2互为同分异构体,G1和G2互为同分异构体.)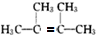 .
. .
.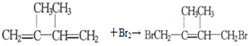 .
.
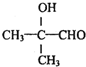 .
.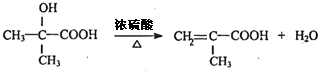 .
.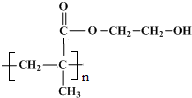 .
.