题目内容
15.已知H2(g)、CO(g)、CH3OH(l)的燃烧热△H分别是-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.下列有关叙述正确的是( )| A. | 甲醇不完全燃烧生成CO和液态水的热化学方程式:CH3OH(l)+O2 (g)═CO(g)+2H2O(l)△H1=-1009.5kJ•mol-1 | |
| B. | CH3OH(l)+$\frac{1}{2}$O2 (g)═CO2(g)+2H2 (g)△H1=-440.7kJ•mol-1 | |
| C. | 2H2O(g)═2H2(g)+O2(g)△H1=+571.6 kJ•mol-1 | |
| D. | 已知:S(s)+O2(g)═SO2(g)△H1;S(g)+O2(g)=SO2(g)△H2;则△H1>△H2 |
分析 A.由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1,
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l);
B.根据甲醇、氢气的燃烧热的热化学方程式及盖斯定律分析;
C.H2(g)的燃烧热△H=-285.8kJ•mol-1,则2H2O(l)═2H2(g)+O2(g)△H1=+571.6 kJ•mol-1;
D.S燃烧为放热反应,1mol气体S具有的能量必1mol固态S高,因此1mol气态S燃烧放热多,焓变小.
解答 解:A.由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-726.5kJ•mol-1-(-283.0kJ•mol-1)=-443.5kJ•mol-1,故A错误;
B.①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1,
②CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.5kJ•mol-1,
根据盖斯定律①-②×2可得:CH3OH(l)+$\frac{1}{2}$O2 (g)═CO2(g)+2H2 (g)△H1=-154.9kJ•mol-1,故B错误;
C.H2(g)的燃烧热△H=-285.8kJ•mol-1,则2H2O(l)═2H2(g)+O2(g)△H1=+571.6 kJ•mol-1,注意水的状态,故C错误;
D.S燃烧为放热反应,1mol气体S具有的能量必1mol固态S高,因此1mol气态S燃烧放热多,焓变小,即为△H1>△H2,故D正确;
故选D.
点评 本题考查了反应热与焓变的应用,题目难度中等,明确燃烧热的概念为解答关键,盖斯定律的内容及应用方法,试题培养了学生的灵活应用能力.

 阅读快车系列答案
阅读快车系列答案| 实验1 | 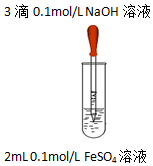 | 实验现象 |
| 液面上方产生白色絮状沉淀,迅速变为灰绿色,振荡,试管壁上有红褐色沉淀生成. |
(2)为了探究沉淀变灰绿色的原因,该小组同学展开如下探究:
①甲同学推测灰绿色物质为Fe(OH)2和Fe(OH)3混合物.查阅资料后根据调色原理认为白色和红褐色的调和色不可能是灰绿色,并设计实验证实灰绿色物质中不含有Fe(OH)3,方案是取一定量的灰绿色沉淀,加入盐酸溶解,再加入KSCN溶液,若溶液不变红色,则证明灰绿色物质中不含有Fe(OH)3.
②乙同学查阅文献:Fe(OH)2在大量SO42-存在的情况下形成Fe6(SO4)2(OH)4O3(一种氧基碱式复盐).并设计对比实验证实该假设:向试管中加入2mL0.1mol/LFeCl2溶液,再往试管中加入3滴0.1mol/LNaOH溶液,振荡,现象与实验1相同,结论是该假设不成立.
③乙同学继续查阅文献:Fe(OH)2沉淀具有较强的吸附性能,灰绿色可能是由Fe(OH)2表面吸附Fe2+引起.推测所用的硫酸亚铁溶液的浓度应越小越好;氢氧化钠溶液浓度应越大越好.设计了如下实验方案:
| 试管中10mL NaOH溶液 | 滴加 FeSO4溶液 | 实验现象 | |
| 实验2 | 6mol/L NaOH溶液 | 0.2mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有少量灰绿色),沉淀下沉后,大部分灰绿色变为白色沉淀 |
| 实验3 | 6mol/L NaOH溶液 | 0.1mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有极少量灰绿色),沉淀下沉后,底部都为白色沉淀 |
(3)丙同学探究温度对氢氧化亚铁制备实验的影响:取少量灰绿色沉淀,在水浴中加热,颜色由灰绿变白,且有絮状白色沉淀下沉,原因为Fe2+在加热时易发生水解,生成Fe(OH)2,因此颜色变白,同时沉淀的量增加,导致出现絮状白色沉淀.
(4)根据以上实验探究,若尽可能制得白色Fe(OH)2沉淀,需要控制的实验条件隔绝氧气、硫酸亚铁少量(或氢氧化钠过量)、硫酸亚铁浓度小(或氢氧化钠浓度大)、将氢氧化钠溶液逐滴加入到硫酸亚铁溶液中、微热等.
| A. | H2 | B. | CO | C. | CH3COOH | D. | C12H22O11 |
| A. | 用量筒量取25.00mL蒸馏水 | B. | 用分液漏斗分离乙醇和水 | ||
| C. | 用烧杯溶解FeCl3试样 | D. | 用托盘天平称量NaCl固体5.80g |
| A. | 具有中性漂白性 | B. | 具有酸性漂白性 | C. | 只有漂白性 | D. | 只有酸性 |
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.