题目内容
11.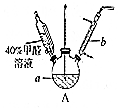 甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发.为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究.
甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发.为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究.(1)在如图装置中进行实验,向a中加入0.5mol•L-1CuSO4溶液50mL和5mol•L-1NaOH溶液100mL,振荡,再加入40%的甲醛溶液50mL,缓慢加热a,在65℃时回流20分钟后冷却至室温.反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生.
①仪器b的名称是球形冷静管,作用为冷凝回流.
②能说明甲醛具有还原性的实验现象是A中出现红色物质(或A中出现棕色物质).
(2)查阅资料发现气体产物是副反应产生的.为确认气体产物中含H2不含CO,将装置A和如图所示的装置连接后进行实验.
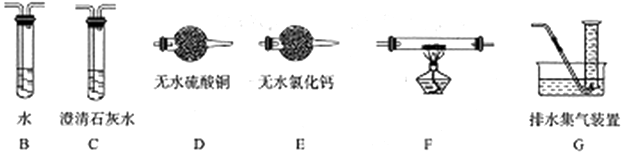
依次连接的合理顺序为A→B→E→F→D→CG,装置B的作用是吸收甲醛蒸气,防止其干扰后续检验.
(3)已知:
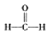 $\stackrel{被氧化}{→}$
$\stackrel{被氧化}{→}$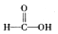 $\stackrel{被氧化}{→}$
$\stackrel{被氧化}{→}$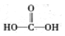 .设计实验证明a中甲醛的碳元素未被氧化成+4价.
.设计实验证明a中甲醛的碳元素未被氧化成+4价.(4)为研究红色固体产物的组成,进行如图实验(以下每步均充分反应);
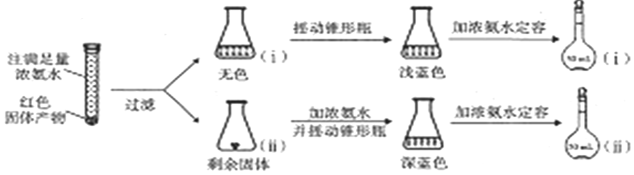
已知:Cu2O$\stackrel{易溶于浓氨水}{→}$[Cu(NH3)4]+(无色)$\stackrel{在空气中}{→}$[Cu(NH3)4]2+](蓝色).
①摇动锥形瓶ⅰ的目的是有利于溶液与空气中的氧气接触.
②锥形瓶ⅱ中固体完全溶解得深蓝色溶液的离子方程式为2Cu+8NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O.
③将容量瓶ⅱ中的溶液稀释100倍后,溶液的颜色与容量瓶ⅰ相近.由此可知固体产物的组成及物质的量之比约为1:200.
分析 (1)①仪器b为球形冷凝管,主要是冷凝回流反应物;
②甲醛具有还原性,和新制氢氧化铜加热反应生成氧化亚铜红色沉淀;
(2)为确认气体产物中含H2不含CO,装置A连接装置B除去甲醛,防止干扰后续实验验证,利用装置E吸收水蒸气,通过装置F中氧化铜加热反应,利用装置D中无水硫酸铜检验是否生成水蒸气,装置C中澄清石灰水检验是否生成二氧化碳验证气体中是否含一氧化碳,通过装置G收集剩余气体;
(3)甲醛被氧化为甲酸,甲酸被氧化为碳酸,若碱溶液中甲醛被氧化生成碳酸盐,加入浓盐酸会生成二氧化碳气体.据此设计实验验证;
(4)①氧化亚铜加入浓氨水得到无色溶液,在空气中变化为蓝色;
②锥形瓶ⅱ中固体完全溶解得深蓝色溶液是铜、氧气和一水合氨溶液反应生成深蓝色络离子;
③反应现象和元素守恒得到固体物质组成为氧化亚铜和铜,将容量瓶ⅱ中的溶液稀释100倍后,溶液的颜色与容量瓶ⅰ相近说明浓度相同;
解答 解:(1)①仪器b为球形冷凝管,主要是冷凝回流反应物,
故答案为:球形冷静管;冷凝回流;
②能说明甲醛具有还原性的实验现象是和新制氢氧化铜加热反应生成氧化亚铜红色沉淀A中出现红色物质(或A中出现棕色物质),
故答案为:A中出现红色物质(或A中出现棕色物质);
(2)为确认气体产物中含H2不含CO,装置A连接装置B除去甲醛,防止干扰后续实验验证,利用装置E吸收水蒸气,通过装置F中氧化铜加热反应,利用装置D中无水硫酸铜检验是否生成水蒸气,装置C中澄清石灰水检验是否生成二氧化碳验证气体中是否含一氧化碳,通过装置G收集剩余气体,依次连接的合理顺序为ABEFDCG,装置B的作用是吸收甲醛蒸气,防止其干扰后续检验,
故答案为:EFDC;吸收甲醛蒸气,防止其干扰后续检验;
(3)甲醛被氧化为甲酸,甲酸被氧化为碳酸,若碱溶液中甲醛被氧化生成碳酸盐,加入浓盐酸会生成二氧化碳气体.设计实验证明a中甲醛的碳元素未被氧化成+4价的方法为:取少量a中反应后的清液,滴入过量的浓盐酸,未见气泡产生,说明甲醛的碳元素未被氧化成+4价,
故答案为:取少量a中反应后的清液,滴入过量的浓盐酸,未见气泡产生,说明甲醛的碳元素未被氧化成+4价;
(4)①氧化亚铜加入浓氨水得到无色溶液,在空气中变化为蓝色,摇动锥形瓶ⅰ的目的是有利于溶液与空气中的氧气接触,
故答案为:有利于溶液与空气中的氧气接触;
②锥形瓶ⅱ中固体完全溶解得深蓝色溶液是铜、氧气和一水合氨溶液反应生成深蓝色络离子,反应的离子方程式为:2Cu+8NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O,
故答案为:2Cu+8NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O;
③将容量瓶ⅱ中的溶液稀释100倍后,溶液的颜色与容量瓶ⅰ相近.由此可知固体产物的组成及物质的量之比约为n(Cu2O):n(Cu)=1:200,
故答案为:1:200;
点评 本题考查了物质组成的实验探究、物质性质、反应现象、实验关系分析判断,掌握基础是解题关键,题目难度中等.

| A. | 可能是纯净物也可能是混合物 | B. | 一定是一种化合物 | ||
| C. | 一定是纯净物 | D. | 一定是一种单质 |
| A. | 15种 | B. | 16种 | C. | 17种 | D. | 18种 |
| A. | 医用酒精的浓度通常为95% | |
| B. | Y(C2H5OH),W(C2H5ONa)可通过消去反应由Y得到W | |
| C. | 实验室中提纯混有少量乙酸的乙醇,可采用先加生石灰,过滤后再蒸馏的方法 | |
| D. | 向无水乙醇中加入浓H2SO4,加热至170℃,产生的气体通入酸性KMnO4溶液,紫红色褪去,使溶液褪色的气体只是乙烯 |
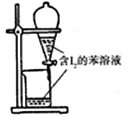
| A.配制0.10mol/LNaOH溶液 | B.观察Fe(OH)2的生成 | C.萃取碘水中的I2分出水层后的操作 | D.记录滴定终点读数为12.20mL |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
| 实验1 | 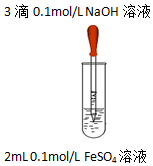 | 实验现象 |
| 液面上方产生白色絮状沉淀,迅速变为灰绿色,振荡,试管壁上有红褐色沉淀生成. |
(2)为了探究沉淀变灰绿色的原因,该小组同学展开如下探究:
①甲同学推测灰绿色物质为Fe(OH)2和Fe(OH)3混合物.查阅资料后根据调色原理认为白色和红褐色的调和色不可能是灰绿色,并设计实验证实灰绿色物质中不含有Fe(OH)3,方案是取一定量的灰绿色沉淀,加入盐酸溶解,再加入KSCN溶液,若溶液不变红色,则证明灰绿色物质中不含有Fe(OH)3.
②乙同学查阅文献:Fe(OH)2在大量SO42-存在的情况下形成Fe6(SO4)2(OH)4O3(一种氧基碱式复盐).并设计对比实验证实该假设:向试管中加入2mL0.1mol/LFeCl2溶液,再往试管中加入3滴0.1mol/LNaOH溶液,振荡,现象与实验1相同,结论是该假设不成立.
③乙同学继续查阅文献:Fe(OH)2沉淀具有较强的吸附性能,灰绿色可能是由Fe(OH)2表面吸附Fe2+引起.推测所用的硫酸亚铁溶液的浓度应越小越好;氢氧化钠溶液浓度应越大越好.设计了如下实验方案:
| 试管中10mL NaOH溶液 | 滴加 FeSO4溶液 | 实验现象 | |
| 实验2 | 6mol/L NaOH溶液 | 0.2mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有少量灰绿色),沉淀下沉后,大部分灰绿色变为白色沉淀 |
| 实验3 | 6mol/L NaOH溶液 | 0.1mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有极少量灰绿色),沉淀下沉后,底部都为白色沉淀 |
(3)丙同学探究温度对氢氧化亚铁制备实验的影响:取少量灰绿色沉淀,在水浴中加热,颜色由灰绿变白,且有絮状白色沉淀下沉,原因为Fe2+在加热时易发生水解,生成Fe(OH)2,因此颜色变白,同时沉淀的量增加,导致出现絮状白色沉淀.
(4)根据以上实验探究,若尽可能制得白色Fe(OH)2沉淀,需要控制的实验条件隔绝氧气、硫酸亚铁少量(或氢氧化钠过量)、硫酸亚铁浓度小(或氢氧化钠浓度大)、将氢氧化钠溶液逐滴加入到硫酸亚铁溶液中、微热等.
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.