题目内容
2.X、Y、Z和M是4种短周期元素,其中X、Y位于同一主族,Y与M、X与Z位于同一周期.X原子最外层电子数是其电子层数的3倍.Z原子的核外电子数比X原子少1.M是同周期中半径最大的元素(除稀有气体元素).下列说法正确的是( )| A. | Y元素最高价氧化物对应水化物的化学式可表示为H2YO3 | |
| B. | Z和M组成的化合物与盐酸反应可以生成两种盐 | |
| C. | X、Y、Z元素的气态氢化物中,Y的沸点最高 | |
| D. | 四种元素简单离子的半径由大到小依次为Y>X>Z>M |
分析 由X原子最外层电子数是其电子层数的3倍推出X是O元素,由X、Y位于同一主族,推出Y是S元素,由Z原子的核外电子数比X原子少1,推出Z是N元素,Y与M同周期,且M是同周期中原子半径最大的元素(除稀有气体元素外),故M是Na元素,根据元素所在周期表的位置结合元素周期律的递变规律解答该题.
解答 解:由X原子最外层电子数是其电子层数的3倍推出X是O元素,由X、Y位于同一主族,推出Y是S元素,由Z原子的核外电子数比X原子少1,推出Z是N元素,Y与M同周期,且M是同周期中原子半径最大的元素(除稀有气体元素外),故M是Na元素,
A.Y为S元素,其最高价氧化物对应水化物的化学式为H2SO4,故A错误;
B.Z、M形成的化合物为Na3N,与盐酸反应生成NaCl、NH4Cl两种盐,故B正确;
C.X、Y、Z元素的气态氢化物中,X(H2O)的沸点最高,故C错误;
D.四种元素简单离子中S2-半径最大,Na+、O2-、N3-电子层结构相同,原子序数越大,离子半径越小,则四种元素简单离子的半径由大到小依次为:Y>Z>X>M,故D错误;
故选B.
点评 本题考查位置结构性质的相互关系应用,题目难度中等,正确推断元素的种类为解答该题的关键,注意把握元素周期律的递变规律,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
12.下列物质所属的类别及其所含官能团的对应关系不正确的是( )
| A. | CH3CH=CH2 烯烃 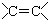 | B. | 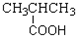 羧酸-COOH 羧酸-COOH | ||
| C. | 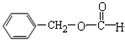 醛类 醛类 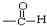 | D. | RCH2OH (R为烃基) 醇类-OH |
10.CH3COOH分子中-CH3及-COOH中碳原子的杂化类型分别是( )
| A. | sp3、sp2 | B. | sp3、sp | C. | sp2、sp | D. | sp2、sp3 |
17.化学与数学有密切的联系,将某些化学知识用数轴表示,可以受到直观形象、简明易记的良好效果.下列用数轴表示的化学知识中错误的是( )
| A. | 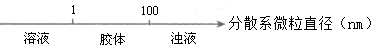 分散系的分类 | |
| B. | 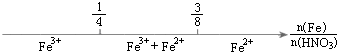 铁与稀硝酸反应后溶液中铁元素的存在形式 | |
| C. | 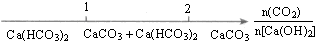 CO2通入澄清石灰水中反应的产物 | |
| D. | 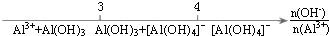 AlCl3溶液中滴加NaOH溶液后Al元素的存在形式 |
14.下列各组分子中都属于只含极性键的极性分子的是( )
| A. | CO2、H2S | B. | SO3、CH4 | C. | N2、C2H2 | D. | NH3、HCl |
11.下列说法正确的是( )
| A. | P4与CH4的空间构型和键角都相同 | |
| B. | O3与OF2都是V形分子 | |
| C. | SO3和SeO32-的立体构型都是三角锥形 | |
| D. | HOCH2CH(OH)CH2OH与CH3CHClCH2CH3都是手性分子 |
12.下列实验中,对应的现象及结论都正确且存在因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 用酒精灯加热摩尔盐(NH4)2Fe(SO4)2•6H2O,产生的气体通过装有无水硫酸铜的干燥管 | 干燥管中的白色粉末先变成天蓝色,后又变成深蓝色 | 加热温度较低时摩尔盐分解产生水蒸气,温度稍高时分解产物中有氨气 |
| B | 向某溶液中滴加BaCl2溶液,随后加稀硝酸酸化 | 溶液中产生白色沉淀,加稀硝酸不溶解 | 原溶液中一定含有SO42- |
| C | 向CuSO4溶液中通入H2S气体 | 溶液的蓝色褪去,生成黑色沉淀 | 氢硫酸的酸性比硫酸强 |
| D | 将干燥的氯气通入放有鲜花的瓶中 | 鲜花褪色 | 说明氯气具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
 ,A、B、C形成的化合物的电子式为
,A、B、C形成的化合物的电子式为 .
.