题目内容
14.下列各组分子中都属于只含极性键的极性分子的是( )| A. | CO2、H2S | B. | SO3、CH4 | C. | N2、C2H2 | D. | NH3、HCl |
分析 由同种原子构成的共价键是非极性键,不同原子构成的共价键是极性键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子
解答 解:A.CO2中含有极性键,但结构对称,正负电荷的中心重合,属于非极性分子;H2S中含有极性键,空间结构为v形,正负电荷的中心不重合,属于极性分子,故A错误;
B.SO3中含有极性键,但结构对称,正负电荷的中心重合,属于非极性分子,CH4中含有极性键,但结构对称,正负电荷的中心重合,属于非极性分子,故B错误;
C.N2属于单质,属于非极性分子;C2H2中含有极性键和非极性键,但结构对称,正负电荷的中心重合,属于非极性分子,故C错误;
D.NH3中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,属于极性分子;HCl中含有极性键,以极性键结合的双原子一定为极性分子,故D正确;
故选:D.
点评 本题主要考查了共价键与分子极性的关系,难度不大,注意非极性分子的结构对称,正负电荷中心重合来解答.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
4.能说明苯不是单双键交替的事实是( )
| A. | 苯的一氯代物只有一种 | B. | 苯的邻位二氯代物只有一种 | ||
| C. | 苯的间位二氯代物只有一种 | D. | 苯的对位二氯代物只有一种 |
5.下列物质中,只含有非极性共价键的是( )
| A. | Na2O2 | B. | KCl | C. | H2S | D. | N2 |
2.X、Y、Z和M是4种短周期元素,其中X、Y位于同一主族,Y与M、X与Z位于同一周期.X原子最外层电子数是其电子层数的3倍.Z原子的核外电子数比X原子少1.M是同周期中半径最大的元素(除稀有气体元素).下列说法正确的是( )
| A. | Y元素最高价氧化物对应水化物的化学式可表示为H2YO3 | |
| B. | Z和M组成的化合物与盐酸反应可以生成两种盐 | |
| C. | X、Y、Z元素的气态氢化物中,Y的沸点最高 | |
| D. | 四种元素简单离子的半径由大到小依次为Y>X>Z>M |
19.下列事实能判断金属元素甲的金属性一定比乙强的有( )
①甲单质能与乙盐的溶液反应
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④甲、乙两元素的单质和盐酸组成原电池,乙单质表面生成氢气
⑤两单质分别与氯气反应时生成的阳离子,甲失去的电子数比乙多.
①甲单质能与乙盐的溶液反应
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④甲、乙两元素的单质和盐酸组成原电池,乙单质表面生成氢气
⑤两单质分别与氯气反应时生成的阳离子,甲失去的电子数比乙多.
| A. | 全部可以 | B. | 仅②不可以 | C. | 仅②⑤不可以 | D. | ③④可以 |
6.下列各组物质中,都是由极性键构成为极性分子的一组的是( )
| A. | NH3和H2S | B. | PCl5和HCl | C. | CH4和H2O | D. | HCN和BF3 |
4.下列有关实验操作不正确的是( )
| A. | 用酒精萃取碘水中的碘 | |
| B. | 丁达尔效应可以区分胶体与溶液 | |
| C. | 化合物氯化钾灼烧透过蓝色钴玻璃片观察为紫色 | |
| D. | 检验氨气是否集满,用湿润的红色石蕊试纸放在集气瓶口 |
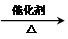
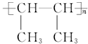 .
.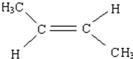 .
.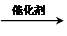 CH2=CH2+(CH3)2C=C(CH3)2.
CH2=CH2+(CH3)2C=C(CH3)2.