题目内容
11.下列说法正确的是( )| A. | P4与CH4的空间构型和键角都相同 | |
| B. | O3与OF2都是V形分子 | |
| C. | SO3和SeO32-的立体构型都是三角锥形 | |
| D. | HOCH2CH(OH)CH2OH与CH3CHClCH2CH3都是手性分子 |
分析 A.P4与CH4的空间构型相同,键角不同;
B.O3与OF2中心原子都是采用sp2杂化,都是V形分子;
C.SO3和SeO32-的立体构型分别为平面三角形、三角锥形;
D.连接四个不同的原子或原子团的碳原子为手性碳原子,含有手性碳原子的分子为手性分子.
解答 解:A.P4与CH4都是正四面体结构,键角分别为60℃、109°28′,两者不同,故A错误;
B.O3中O原子形成2个σ键,孤对电子数为$\frac{1}{2}$(6-2×2)=1,所以立体构型为V型,OF2中O原子的价层电子对数为2+$\frac{1}{2}$(6-2×1)=4,含有2个孤电子对,分子结构属于V形,故B正确;
C.在SO3分子中,硫原子周围的价电子对数为3+$\frac{1}{2}$(6-3×2)=3,所以SO3的立体构型为平面三角形,在SeO32-的中硒原子周围的价电子对数为3+$\frac{1}{2}$(6+2-3×2)=4,所以SeO32-的立体构型为三角锥形,故C错误;
D.CH3CHClCH2CH3是手性分子,HOCH2CH(OH)CH2OH不是手性分子,故D错误;
故选B.
点评 本题考查微粒的空间构型以及手性分子的判断,熟练掌握价层电子对互斥理论是解答关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.关于如图所示的氢氧燃料电池的说法错误的是( )
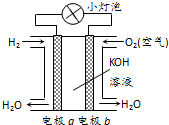

| A. | 电极a是负极 | |
| B. | 电极a上的电极反应为2H2-4e-=4H+ | |
| C. | 外电路中电子由电极a流向电极b | |
| D. | 氢氧燃料电池的优点是高效、对环境友好 |
2.X、Y、Z和M是4种短周期元素,其中X、Y位于同一主族,Y与M、X与Z位于同一周期.X原子最外层电子数是其电子层数的3倍.Z原子的核外电子数比X原子少1.M是同周期中半径最大的元素(除稀有气体元素).下列说法正确的是( )
| A. | Y元素最高价氧化物对应水化物的化学式可表示为H2YO3 | |
| B. | Z和M组成的化合物与盐酸反应可以生成两种盐 | |
| C. | X、Y、Z元素的气态氢化物中,Y的沸点最高 | |
| D. | 四种元素简单离子的半径由大到小依次为Y>X>Z>M |
19.下列事实能判断金属元素甲的金属性一定比乙强的有( )
①甲单质能与乙盐的溶液反应
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④甲、乙两元素的单质和盐酸组成原电池,乙单质表面生成氢气
⑤两单质分别与氯气反应时生成的阳离子,甲失去的电子数比乙多.
①甲单质能与乙盐的溶液反应
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④甲、乙两元素的单质和盐酸组成原电池,乙单质表面生成氢气
⑤两单质分别与氯气反应时生成的阳离子,甲失去的电子数比乙多.
| A. | 全部可以 | B. | 仅②不可以 | C. | 仅②⑤不可以 | D. | ③④可以 |
6.下列各组物质中,都是由极性键构成为极性分子的一组的是( )
| A. | NH3和H2S | B. | PCl5和HCl | C. | CH4和H2O | D. | HCN和BF3 |
1.一定条件下,在体积一定的密闭容器中加入1molN2和3molH2发生反应:N2+3H2$?_{高温高压}^{催化剂}$2NH3(正反应是放热反应).下列有关说法正确的是( )
| A. | 达到化学反应限度时,生成2mol NH3 | |
| B. | 向容器中再加入N2,可以加快反应速率 | |
| C. | 降低温度可以加快反应速率 | |
| D. | 1mol N2 和3mol H2的总能量低于2mol NH3的总能量 |

 .
. .
. CH2=CH2+(CH3)2C=C(CH3)2.
CH2=CH2+(CH3)2C=C(CH3)2.