题目内容
3.下表是元素周期表的一部分,有关说法正确的是( )| 族周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 2 | a | c | e | g | |||
| 3 | b | d | f | h |
| A. | a单质的熔点、沸点比b单质高 | |
| B. | 八种元素中,b元素单质的化学性质最活泼 | |
| C. | 八种元素的单质中,常温下有五种固体 | |
| D. | c、d、f、h的最高价氧化物对应的水化物的酸性依次增强 |
分析 根据图示可知,a为Li元素、b为Na元素、c为C元素、d为Si元素、e为O元素、f为S元素、g为F元素、h为Cl元素,然后结合元素周期律知识解答.
解答 解:根据图示可知,a为Li元素、b为Na元素、c为C元素、d为Si元素、e为O元素、f为S元素、g为F元素、h为Cl元素,
A.碱金属元素的单质,原子序数越大,熔沸点越低,原子序数a<b,则单质的熔沸点a>b,故A正确;
B.八种元素中,单质还原性最强的为Na,单质氧化性最强的为氟气,必须指出氧化性还是还原性,故B错误;
C.八种元素的单质中,Li、Na、C、Si和S的单质在常温下为固态,其它为气态,即常温下有五种固体,故C正确;
D.非金属性越强,最高价含氧酸的酸性越强,非金属性h>f>d>c,则最高价氧化物对应水合物的酸性:h>f>d>c,故D错误;
故选AC.
点评 本题考查了位置结构与性质关系的应用,题目难度中等,明确元素周期表结构为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

练习册系列答案
相关题目
13.下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A. | H +NO3- Fe 2+Na + | B. | Ag +NO3- Cl -K + | ||
| C. | K +Ba 2+OH -SO42- | D. | Cu 2+NH4+ Br -OH - |
11.同一周期的X、Y、Z三种元素,已知最高价氧化物水化物酸性强弱是:HXO4>H2YO4>H3ZO4,则下列判断不正确的是( )
| A. | 原子半径:X>Y>Z | |
| B. | 气态氢化物稳定性按X、Y、Z依次减弱 | |
| C. | 非金属性:X>Y>Z | |
| D. | 阴离子还原性:X-<Y2-<Z3- |
18.将78g金属钾在空气中燃烧,生成KO2和K2O2的混合物.该混合物与足量的CO2充分反应后生成O2(4KO2+2CO2→2K2CO3+3O2),得到O2的物质的量可能为( )
| A. | 0.50 mol | B. | 0.75 mol | C. | 1.00 mol | D. | 1.50 mol |
15.将标准状况下的VL CO2通入含有a mol氢氧化钠的溶液中经充分反应得溶液I.下列对溶液I中溶质分析正确的是( )
| A. | 溶液I中含有溶质的组合可能有4种 | |
| B. | 已知V和a的具体数值可以确定溶液I的溶质 | |
| C. | 已知溶液I中溶质的种类和a值,一定能求出V | |
| D. | 向溶液I中加入足量Ba(OH)2溶液充分反应后,过滤出沉淀,经烘干得固体质量为W克.由W和V的值可确定溶液I的溶质 |
12.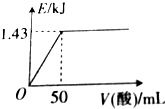 向50mL0.5mol•L-1NaOH溶液中加入某种浓度的稀硫酸,测得加入稀硫酸的体积与反应放出的热量关系如图所示(不考虑热量损失),该稀硫酸中硫酸的物质的量浓度为( )
向50mL0.5mol•L-1NaOH溶液中加入某种浓度的稀硫酸,测得加入稀硫酸的体积与反应放出的热量关系如图所示(不考虑热量损失),该稀硫酸中硫酸的物质的量浓度为( )
 向50mL0.5mol•L-1NaOH溶液中加入某种浓度的稀硫酸,测得加入稀硫酸的体积与反应放出的热量关系如图所示(不考虑热量损失),该稀硫酸中硫酸的物质的量浓度为( )
向50mL0.5mol•L-1NaOH溶液中加入某种浓度的稀硫酸,测得加入稀硫酸的体积与反应放出的热量关系如图所示(不考虑热量损失),该稀硫酸中硫酸的物质的量浓度为( )| A. | 0.5mol•L-1 | B. | 0.4mol•L-1 | C. | 0.25mol•L-1 | D. | 0.1mol•L-1 |
 除电解法,工业炼镁还可采用硅热法(Pidgeon法).即以煅白(CaO•MgO)为原料与硅铁(含硅75%的硅铁合金)混合置于密闭还原炉,1200℃下发生反应:2(CaO•MgO)(s)+Si(s)?Ca2SiO4 (l)+2Mg(g)
除电解法,工业炼镁还可采用硅热法(Pidgeon法).即以煅白(CaO•MgO)为原料与硅铁(含硅75%的硅铁合金)混合置于密闭还原炉,1200℃下发生反应:2(CaO•MgO)(s)+Si(s)?Ca2SiO4 (l)+2Mg(g)
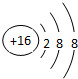 ;D与E能形成一种非极性分子,该分子的结构式为S=C=S;E的单质中,质软有润滑性的是石墨(填写单质名称).
;D与E能形成一种非极性分子,该分子的结构式为S=C=S;E的单质中,质软有润滑性的是石墨(填写单质名称).
 (其中一种)(写结构简式,一种即可).
(其中一种)(写结构简式,一种即可). +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaCl
+NaCl +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$