题目内容
12.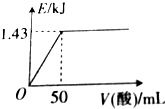 向50mL0.5mol•L-1NaOH溶液中加入某种浓度的稀硫酸,测得加入稀硫酸的体积与反应放出的热量关系如图所示(不考虑热量损失),该稀硫酸中硫酸的物质的量浓度为( )
向50mL0.5mol•L-1NaOH溶液中加入某种浓度的稀硫酸,测得加入稀硫酸的体积与反应放出的热量关系如图所示(不考虑热量损失),该稀硫酸中硫酸的物质的量浓度为( )| A. | 0.5mol•L-1 | B. | 0.4mol•L-1 | C. | 0.25mol•L-1 | D. | 0.1mol•L-1 |
分析 当氢氧化钠与硫酸恰好反应时放出热量最多,根据图象可知,加入50mL稀硫酸时放出热量最多,此时NaOH与硫酸恰好反应,根据反应关系式计算出硫酸的物质的量,再根据c=$\frac{n}{V}$计算出该硫酸的浓度.
解答 解:50mL0.5mol•L-1NaOH溶液中含有氢氧化钠的物质的量为:n(NaOH)=0.5mol/L×0.05L=0.025mol,
根据图象可知,加入50mL稀硫酸时放出热量最多,此时NaOH与硫酸恰好反应,根据反应关系式2NaOH~H2SO4可知,50mL该稀硫酸中含有硫酸的物质的量为:n(H2SO4)=$\frac{1}{2}$n(NaOH)=0.025mol×$\frac{1}{2}$=0.0125mol,
该稀硫酸的物质的量浓度为:c(H2SO4)=$\frac{0.0125mol}{0.05L}$=0.25mol/L,
故选C.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确图象曲线变化的含义为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
2.下列事实与元素周期律相关知识无关的是( )
| A. | 向淀粉KI 溶液中滴入溴水,溶液变蓝 | |
| B. | NaOH、Mg(OH)2、Al(OH) 3的碱性依次减弱 | |
| C. | 金属钠燃烧呈现黄色火焰,金属钾燃烧呈现紫色火焰 | |
| D. | F2和H2 暗处化合爆炸,而Cl2 和H2 化合需光照或点燃 |
3.下表是元素周期表的一部分,有关说法正确的是( )
| 族周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 2 | a | c | e | g | |||
| 3 | b | d | f | h |
| A. | a单质的熔点、沸点比b单质高 | |
| B. | 八种元素中,b元素单质的化学性质最活泼 | |
| C. | 八种元素的单质中,常温下有五种固体 | |
| D. | c、d、f、h的最高价氧化物对应的水化物的酸性依次增强 |
20.将0.5mol下列物质分别加入100mL 5mol/L NaOH溶液中,完全反应后,所得溶液中阴离子浓度的大小顺序是( )
①Al ②Al2O3 ③Al(OH)3 ④AlCl3.
①Al ②Al2O3 ③Al(OH)3 ④AlCl3.
| A. | ①>②>③>④ | B. | ④>①>②>③ | C. | ②>①=③>④ | D. | ①>②=③>④ |
4. 如图所示,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是( )
如图所示,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是( )
 如图所示,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是( )
如图所示,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是( )| 编 号 | ① | ② | ③ | ④ |
| A中气体 | H2S | H2 | NH3 | NO |
| B中气体 | SO2 | Cl2 | HCl | O2 |
| A. | ②③④① | B. | ③①④② | C. | ③②①④ | D. | ④③②① |
1.城市饮用水的消毒剂有多种,液氯、漂白粉、二氧化氯、臭氧等,臭氧作为一种理想的消毒剂,杀菌能力强且不会影响水质,这是利用了臭氧的( )
| A. | 强还原性 | B. | 强氧化性 | C. | 助燃性 | D. | 不稳定性 |
2.下列反应的离子方程式正确的是( )
| A. | Cu与浓硝酸反应制NO2:Cu+4HNO3(浓)═Cu2++2NO3-+2NO2↑+2H2O | |
| B. | 向Fe(NO3)2溶液中加入盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O | |
| C. | 碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- |