题目内容
15.将标准状况下的VL CO2通入含有a mol氢氧化钠的溶液中经充分反应得溶液I.下列对溶液I中溶质分析正确的是( )| A. | 溶液I中含有溶质的组合可能有4种 | |
| B. | 已知V和a的具体数值可以确定溶液I的溶质 | |
| C. | 已知溶液I中溶质的种类和a值,一定能求出V | |
| D. | 向溶液I中加入足量Ba(OH)2溶液充分反应后,过滤出沉淀,经烘干得固体质量为W克.由W和V的值可确定溶液I的溶质 |
分析 CO2与NaOH反应为①CO2+NaOH=NaHCO3,②CO2+2NaOH=Na2CO3+H2O,
当n(CO2):n(NaOH)≥1:1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成生成NaHCO3,CO2有剩余;
当$\frac{1}{2}$<n(CO2):n(NaOH)<1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;
当n(CO2):n(NaOH)≤2,反应按②进行,等于2时,CO2、NaOH恰好反应生成Na2CO3;小于2时,生成Na2CO3,NaOH有剩余,据此讨论结合选项解答.
解答 解:CO2与NaOH反应为①CO2+NaOH=NaHCO3,②CO2+2NaOH=Na2CO3+H2O,
当n(CO2):n(NaOH)≥1:1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成生成NaHCO3,CO2有剩余;
当$\frac{1}{2}$<n(CO2):n(NaOH)<1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;
当n(CO2):n(NaOH)≤2,反应按②进行,等于2时,CO2、NaOH恰好反应生成Na2CO3;小于2时,生成Na2CO3,NaOH有剩余;
A.由上述分析可知,溶液I中含有溶质可能有:①NaHCO3,②NaHCO3、Na2CO3,③Na2CO3,④Na2CO3、NaOH,故A正确;
B.已知V和a的具体数值,可以确定n(CO2):n(NaOH)比值范围,根据上述分析可以判断溶液I的溶质,故B正确;
C.根据A可知,若溶质为①NaHCO3,②NaHCO3、Na2CO3,③Na2CO3,可以计算出V,但溶质为Na2CO3、NaOH时无法计算出V,故C错误;
D.向溶液I中加入足量Ba(OH)2溶液充分反应后,所得沉淀为碳酸钡,即W克为碳酸钡的质量,根据W和V的值可确二氧化碳的物质的量,不能确定氢氧化钠的物质的量,不能判断溶液中溶质情况,故D错误;
故选AB.
点评 本题考查根据反应进行的讨论计算,难度中等,判断CO2与NaOH反应过程是关键,根据二者发生反应结合过量计算分析.

| A. | 1 mol H2O的质量为18g/mol | B. | 3.01×1023个SO2分子的质量为32g | ||
| C. | CH4的摩尔质量为16g | D. | 44g CO2含有的O原子数为NA |
为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一等容的密闭容器中,用气体传感器测得了不同时间的NO和CO的浓度如表(CO2和N2的起始浓度为0).
| 时间 (s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (×10-4,mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO) (×10-3,mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(1)已知在上述反应中,反应物总能量大于生成物总能量,则正反应是放热反应(填“放热”或“吸热”).
(2)前3s内的平均反应速率:υ(N2)=1.42×10-4mol/(L•s).
(3)t1℃时该反应的平衡常数表达式:K=$\frac{{c}^{2}(C{O}_{2})×c({N}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$.
(4)假设在密闭容器中该反应达到平衡后,改变下列条件,能提高NO转化率的是cd(选填答案编号).
a.选用更有效的催化剂 b.升高反应体系的温度
c.降低反应体系的温度 d.缩小容器的体积.
| 族周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 2 | a | c | e | g | |||
| 3 | b | d | f | h |
| A. | a单质的熔点、沸点比b单质高 | |
| B. | 八种元素中,b元素单质的化学性质最活泼 | |
| C. | 八种元素的单质中,常温下有五种固体 | |
| D. | c、d、f、h的最高价氧化物对应的水化物的酸性依次增强 |
 呋喃甲醛(即糠醛)的结构简式如图,其分子中的环和苯环有相似的化学性质(即有“芳香性”),则关于糠醛的叙述错误的是( )
呋喃甲醛(即糠醛)的结构简式如图,其分子中的环和苯环有相似的化学性质(即有“芳香性”),则关于糠醛的叙述错误的是( )| A. | 能生成呋喃甲醇 | B. | 能生成呋喃甲酸 | ||
| C. | 能与溴水生成多种加成产物 | D. | 能与苯酚制备糠醛树脂 |
①Al ②Al2O3 ③Al(OH)3 ④AlCl3.
| A. | ①>②>③>④ | B. | ④>①>②>③ | C. | ②>①=③>④ | D. | ①>②=③>④ |
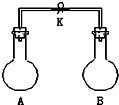 如图所示,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是( )
如图所示,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是( )| 编 号 | ① | ② | ③ | ④ |
| A中气体 | H2S | H2 | NH3 | NO |
| B中气体 | SO2 | Cl2 | HCl | O2 |
| A. | ②③④① | B. | ③①④② | C. | ③②①④ | D. | ④③②① |
| A. | CaCO3和HCl;Na2CO3和HCl | B. | BaCl2 和H2SO4;Ba(OH)2和H2SO4 | ||
| C. | HCl 和Na2CO3;HCl和NaHCO3 | D. | KOH 和H2SO4;Ba(OH)2和HNO3 |