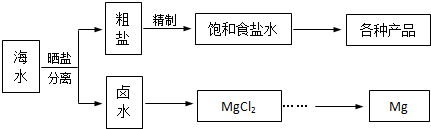
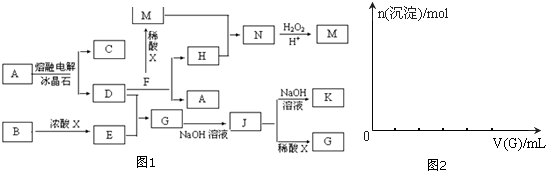
题目内容
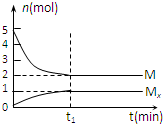 E是非金属性最强的元素,M是E的气态氢化物,在一定体积的密闭容器中,气体M存在如下关系:aM(g)?bMx(g ),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
E是非金属性最强的元素,M是E的气态氢化物,在一定体积的密闭容器中,气体M存在如下关系:aM(g)?bMx(g ),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )| A、该反应的化学方程式是2HF?(HF)2 |
| B、时刻,保持温度不变,再充入5molM,重新达到平衡时,将减小 |
| C、平衡时混合气体的平均摩尔质量是33.3g/mol |
| D、M的沸点比同主族下一周期元素的气态氢化物沸点低 |
考点:物质的量或浓度随时间的变化曲线
专题:
分析:A.E是非金属性最强的元素,所以E是F元素,M是E的气态氢化物,即为HF,根据M和Mx的物质的量的变化量可写出化学方程式;
B.t1时刻,保持温度不变,再充入5molM,相当于对原平衡加压,据此判断;
C.根据质量守恒定律可计算出总质量,然后根据平均摩尔质量
=
计算;
D.由于HF分子之间有氢键的存在,所以HF的沸点比同主族下一周期元素的气态氢化物沸点高,据此判断.
B.t1时刻,保持温度不变,再充入5molM,相当于对原平衡加压,据此判断;
C.根据质量守恒定律可计算出总质量,然后根据平均摩尔质量
. |
| M |
| m |
| n总 |
D.由于HF分子之间有氢键的存在,所以HF的沸点比同主族下一周期元素的气态氢化物沸点高,据此判断.
解答:
解:A.根据E是非金属性最强的元素,所以E是F元素,M是E的气态氢化物,即为HF,根据M的变化量为3mol和Mx的物质的量的变化量为1mol,故化学方程式为3HF?(HF)3,故A错误;
B.t1时刻,保持温度不变,再充入5molM,相当于对原平衡加压,结合A中的化学方程式可知,平衡正向移动,Mx与M的浓度比
增大,故B错误;
C.反应前后都是气体,根据质量守恒定律,达到平衡时总质量为:20g/mol×5mol=100g,则混合气体的平均摩尔质量为:
=33.3g/mol,故C正确;
D.由于HF分子之间有氢键的存在,所以HF的沸点比同主族下一周期元素的气态氢化物沸点高,故D错误;
故选C.
B.t1时刻,保持温度不变,再充入5molM,相当于对原平衡加压,结合A中的化学方程式可知,平衡正向移动,Mx与M的浓度比
| c(Mx) |
| c(M) |
C.反应前后都是气体,根据质量守恒定律,达到平衡时总质量为:20g/mol×5mol=100g,则混合气体的平均摩尔质量为:
| 100g |
| 2mol+1mol |
D.由于HF分子之间有氢键的存在,所以HF的沸点比同主族下一周期元素的气态氢化物沸点高,故D错误;
故选C.
点评:本题主要考查了元素推断、根据图象书写化学方程式、平衡移动的影响因素、平均摩尔质量的计算等知识,题目难度中等,正确分析图象曲线的变化为解答本题的关键,注意掌握影响化学平衡的元素.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
下列关于乙烯和聚乙烯的叙述不正确的是( )
| A、乙烯常温下是气体,为纯净物;聚乙烯常温下是固体,为混合物 |
| B、乙烯的化学性质比聚乙烯活泼 |
| C、取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 |
| D、取等物质的量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的物质的量分别相等 |
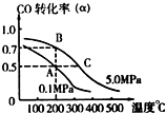 密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)=CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示.下列说法正确的是( )
密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)=CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示.下列说法正确的是( )| A、在 A、B两点对应的容器中,n(A)总:n(B)总=4:5 |
| B、在 A、C两点对应的容器中自反应开始到平衡状态所需的时间tA,<tC |
| C、设B、C两点的平衡常数分别为KB、KC,则KB<KC |
| D、在不改变反应物用量的情况下,降温、加压、将甲醇从混合体系中分离出来均可提高CO的转化率 |
对于可逆反应N2(g)+3H2(g)
2NH3(g),在不同条件下的化学全品高考网“反应速率如下,其中表示反应速率最快的是( )
| 催化剂 |
| 高温高压 |
| A、υ(H2)=0.3mol/(L?min) |
| B、υ(N2)=0.2mol/(L?min) |
| C、υ(NH3)=0.25mol/(L?min) |
| D、υ(H2)=0.4mol/(L?min) |
X、Y、Z、W为原子序数依次增大的短周期元素.其形成的小分子化合物Y2X2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构.下列说法正确的是( )
| A、X、Y、Z、W的原子半径的大小关系为:W>Y>Z>X |
| B、在化合物Y2X2、Z2X4、X2W2中,分子所含的共用电子对数相等 |
| C、与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键 |
| D、X、Y、Z、W四种元素可形成化学式为X7Y2ZW2的有机物 |
下列离子方程式或化学方程式与所述事实相符且正确的是( )
| A、将2molSO3气体通入一密闭容器中,达平衡后吸收QkJ热量,则2SO3(g)?2SO2(g)+O2(g)△H=+Q KJ/mol |
| B、向含有0.4molFeBr2的溶液中通入0.2molCl2充分反应:2Fe2++Cl2=2Fe3++2Cl- |
| C、NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| D、将FeCl3饱和溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ |