题目内容
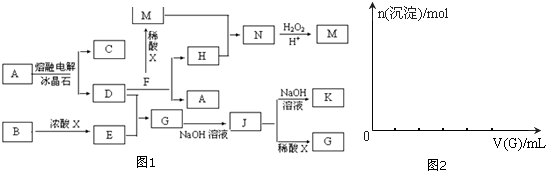
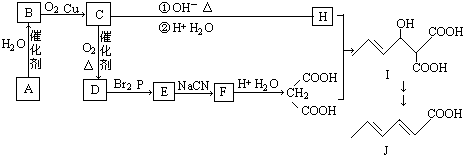
图1中转化关系所涉及的物质都是中学化学常见物质.已知A、B、F为固体氧化物,F为红棕色;C、E为气体单质.
(1)根据图1中信息,写出下列反应的离子方程式:
①K中通入过量CO2:
②N转化为M的反应:
(2)B与浓酸X反应中氧化剂与还原剂物质的量之比:
(3)M溶液调节pH可以转化为红褐色沉淀.已知25℃沉淀的Ksp=8×10-38,要使M溶液中阳离子沉淀完全,(离子浓度降至1.0×10-5 mol?L-1,视为沉淀完全),则溶液的c(OH-)=
(4)已知2D (s)+
O2(g)═A(s)△H=-1644.3kJ?mol-12H (s)+
O2(g)═F(s)△H=-815.88kJ?mol-1试写出D与F粉末发生反应的热化学方程式:
(5)向NaOH溶液中逐滴加入G溶液至过量,请在图2中画出沉淀的物质的量随G溶液体积的变化图象.

(1)根据图1中信息,写出下列反应的离子方程式:
①K中通入过量CO2:
②N转化为M的反应:
(2)B与浓酸X反应中氧化剂与还原剂物质的量之比:
(3)M溶液调节pH可以转化为红褐色沉淀.已知25℃沉淀的Ksp=8×10-38,要使M溶液中阳离子沉淀完全,(离子浓度降至1.0×10-5 mol?L-1,视为沉淀完全),则溶液的c(OH-)=
(4)已知2D (s)+
| 3 |
| 2 |
| 3 |
| 2 |
(5)向NaOH溶液中逐滴加入G溶液至过量,请在图2中画出沉淀的物质的量随G溶液体积的变化图象.
考点:无机物的推断
专题:推断题
分析:A、B、F为固体氧化物,C、E为气体单质,其中F为红棕色,则F应为Fe2O3,电解A得到C与D,D与氧化铁反应得到H与A,可推知A为Al2O3,C为O2,D为Al,H为Fe,固体氧化物B与浓酸X反应得到气体单质E,应是制备氯气的反应,B为MnO2,X为盐酸,E为Cl2,由转化关系可知,G为AlCl3,J为Al(OH)3,K为NaAlO2,M为FeCl3,N为FeCl2,M为FeCl3,据此解答.
解答:
解:A、B、F为固体氧化物,C、E为气体单质,其中F为红棕色,则F应为Fe2O3,电解A得到C与D,D与氧化铁反应得到H与A,可推知A为Al2O3,C为O2,D为Al,H为Fe,固体氧化物B与浓酸X反应得到气体单质E,应是制备氯气的反应,B为MnO2,X为盐酸,E为Cl2,由转化关系可知,G为AlCl3,J为Al(OH)3,K为NaAlO2,M为FeCl3,N为FeCl2,M为FeCl3,
(1)①K中通入过量CO2的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
②N转化为M的反应的离子方程式:2Fe2++2H++H2O2=2Fe3++2H2O,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;2Fe2++2H++H2O2=2Fe3++2H2O;
(2)B与浓酸X反应为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,氧化剂为MnO2,还原剂为HCl,被氧化为氯气,反应中氧化剂与还原剂物质的量之比为1:2,故答案为:1:2;
(3)FeCl3溶液调节pH可以转化为Fe(OH)3红褐色沉淀.已知25℃沉淀的Ksp=8×10-38,要使M溶液中阳离子沉淀完全,(离子浓度降至1.0×10-5 mol?L-1,视为沉淀完全),则溶液的c(OH-)=
mol/L=2×10-11 mol/L,故答案为:2×10-11 mol/L;
(4)已知:①2Al (s)+
O2(g)═Al2O3(s)△H=-1644.3kJ?mol-1
②2Fe (s)+
O2(g)═Fe2O3(s)△H=-815.88kJ?mol-1,
①-②可得Al与Fe2O3粉末发生反应的热化学方程式:2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s))△H=-828.42kJmol-1,
故答案为:2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s))△H=-828.42kJmol-1;
(5)向NaOH溶液中逐滴加入AlCl3溶液至过量,开始发生反应:Al3++4OH-=AlO2-+2H2O,然后发生反应3AlO2-+Al3++6H2O=4Al(OH)3↓,前后两阶段消耗AlCl3的物质的量为3:1,则沉淀的物质的量随AlCl3溶液体积的变化图象为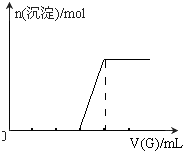 ,故答案为:
,故答案为: .
.
(1)①K中通入过量CO2的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
②N转化为M的反应的离子方程式:2Fe2++2H++H2O2=2Fe3++2H2O,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;2Fe2++2H++H2O2=2Fe3++2H2O;
(2)B与浓酸X反应为MnO2+4HCl(浓)
| ||
(3)FeCl3溶液调节pH可以转化为Fe(OH)3红褐色沉淀.已知25℃沉淀的Ksp=8×10-38,要使M溶液中阳离子沉淀完全,(离子浓度降至1.0×10-5 mol?L-1,视为沉淀完全),则溶液的c(OH-)=
| 3 |
| ||
(4)已知:①2Al (s)+
| 3 |
| 2 |
②2Fe (s)+
| 3 |
| 2 |
①-②可得Al与Fe2O3粉末发生反应的热化学方程式:2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s))△H=-828.42kJmol-1,
故答案为:2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s))△H=-828.42kJmol-1;
(5)向NaOH溶液中逐滴加入AlCl3溶液至过量,开始发生反应:Al3++4OH-=AlO2-+2H2O,然后发生反应3AlO2-+Al3++6H2O=4Al(OH)3↓,前后两阶段消耗AlCl3的物质的量为3:1,则沉淀的物质的量随AlCl3溶液体积的变化图象为
 ,故答案为:
,故答案为: .
.
点评:本题考查无机物推断,物质的颜色、状态等是推断突破口,再结合特殊反应进行推断,需要学生熟练掌握元素化合物知识,侧重考查学生对知识的综合运用能力,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列关于有机物的叙述正确的是( )
| A、我国居民传统膳食以糖类为主,淀粉、脂肪都是糖类物质 |
| B、人体内的蛋白质不断分解,最终生成水和二氧化碳排出体外 |
| C、乙醇可以被氧化为乙酸,二者均能发生酯化反应 |
| D、用氢氧化钠溶液可除去乙酸乙酯中混有的少量的乙酸 |
下列说法正确的是( )
| A、食用加碘盐可预防碘缺乏症,加碘盐中加的含碘物质是碘单质 |
| B、因为NaCl的水溶液能导电,所以NaCl溶液属于强电解质 |
| C、电解熔融NaCl得到23.0g金属钠时能产生22.4 L氯气(标准状况下) |
| D、37Cl 是氯元素的一种同位素,23Na37Cl中质子数和中子数之比是7:8 |
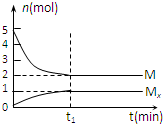 E是非金属性最强的元素,M是E的气态氢化物,在一定体积的密闭容器中,气体M存在如下关系:aM(g)?bMx(g ),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
E是非金属性最强的元素,M是E的气态氢化物,在一定体积的密闭容器中,气体M存在如下关系:aM(g)?bMx(g ),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )| A、该反应的化学方程式是2HF?(HF)2 |
| B、时刻,保持温度不变,再充入5molM,重新达到平衡时,将减小 |
| C、平衡时混合气体的平均摩尔质量是33.3g/mol |
| D、M的沸点比同主族下一周期元素的气态氢化物沸点低 |
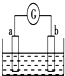 如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是( )
如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是( )| A、a为负极,是铁片,烧杯中的溶液为稀硫酸 |
| B、b为负极,是铁片,烧杯中的溶液为硫酸铜溶液 |
| C、a为正极,是碳棒,烧杯中的溶液为稀硫酸 |
| D、b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液 |
 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.