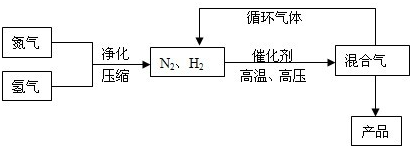
题目内容
下列离子方程式或化学方程式与所述事实相符且正确的是( )
| A、将2molSO3气体通入一密闭容器中,达平衡后吸收QkJ热量,则2SO3(g)?2SO2(g)+O2(g)△H=+Q KJ/mol |
| B、向含有0.4molFeBr2的溶液中通入0.2molCl2充分反应:2Fe2++Cl2=2Fe3++2Cl- |
| C、NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| D、将FeCl3饱和溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ |
考点:离子方程式的书写
专题:
分析:A.2SO3(g)?2SO2(g)+O2(g)为可逆反应,2molSO3气体通入一密闭容器中不能完全反应;
B.二价铁离子还原性强于溴离子,氯气先氧化二价铁,然后再氧化溴离子;
C.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀,生成一水合氨、氢氧化铝和硫酸钡;
D.将FeCl3饱和溶液滴入沸水中制取Fe(OH)3胶体,得到的胶体不是沉淀,不能标沉淀符号.
B.二价铁离子还原性强于溴离子,氯气先氧化二价铁,然后再氧化溴离子;
C.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀,生成一水合氨、氢氧化铝和硫酸钡;
D.将FeCl3饱和溶液滴入沸水中制取Fe(OH)3胶体,得到的胶体不是沉淀,不能标沉淀符号.
解答:
解:A.2SO3(g)?2SO2(g)+O2(g)为可逆反应,2molSO3气体通入一密闭容器中不能完全反应,所以2SO3(g)?2SO2(g)+O2(g)△H>+Q KJ/mol,故A错误;
B.0.4molFeBr2含二价铁离子0.4mol,0.2molCl2不足,只能氧化二价铁离子,离子方程式:2Fe2++Cl2=2Fe3++2Cl-,故B正确;
C.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3.H2O,故C错误;
D.将FeCl3饱和溶液滴入沸水中制取Fe(OH)3胶体,离子方程式:Fe3++3H2O?Fe(OH)3(胶体)+3H+,故D错误;
故选:B.
B.0.4molFeBr2含二价铁离子0.4mol,0.2molCl2不足,只能氧化二价铁离子,离子方程式:2Fe2++Cl2=2Fe3++2Cl-,故B正确;
C.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3.H2O,故C错误;
D.将FeCl3饱和溶液滴入沸水中制取Fe(OH)3胶体,离子方程式:Fe3++3H2O?Fe(OH)3(胶体)+3H+,故D错误;
故选:B.
点评:本题考查了离子方程式的书写,题目难度不大,明确反应实质是解题关键,注意反应物用量对化学反应的影响,注意氢氧化铁胶体的性质,选项BD为易错选项.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
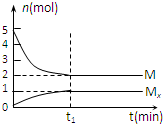 E是非金属性最强的元素,M是E的气态氢化物,在一定体积的密闭容器中,气体M存在如下关系:aM(g)?bMx(g ),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
E是非金属性最强的元素,M是E的气态氢化物,在一定体积的密闭容器中,气体M存在如下关系:aM(g)?bMx(g ),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )| A、该反应的化学方程式是2HF?(HF)2 |
| B、时刻,保持温度不变,再充入5molM,重新达到平衡时,将减小 |
| C、平衡时混合气体的平均摩尔质量是33.3g/mol |
| D、M的沸点比同主族下一周期元素的气态氢化物沸点低 |
NA代表阿伏加德罗常数,下列说法不正确的是( )
| A、标准状况下,11.2L氯仿(CHCl3)中含有C-Cl键的数目为1.5NA |
| B、常温常压下,15g甲基(-CH3)所含的电子数为9NA |
| C、同温同压下,1LNO和1LO2充分混合体积小于1.5L |
| D、pH=l的醋酸溶液100mL中氢离子数为0.01 NA |
在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的情况,下列反应中属于这种情况的是( )
①过量的锌与浓硫酸反应;
②过量的氢气与少量的N2在工业生产条件下反应;
③过量的浓盐酸与碳酸钙反应;
④过量的乙酸和少量乙醇在浓硫酸、加热条件下反应;
⑤过量二氧化锰与浓盐酸在加热条件下反应;
⑥过量的铜与浓硫酸在加热条件下反应.
①过量的锌与浓硫酸反应;
②过量的氢气与少量的N2在工业生产条件下反应;
③过量的浓盐酸与碳酸钙反应;
④过量的乙酸和少量乙醇在浓硫酸、加热条件下反应;
⑤过量二氧化锰与浓盐酸在加热条件下反应;
⑥过量的铜与浓硫酸在加热条件下反应.
| A、②③④⑥ | B、①②④⑤ |
| C、②④⑤⑥ | D、③④⑤⑥ |
设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A、0.1mol Fe 与0.1mol Cl2充分反应,转移的电子数为0.3 NA |
| B、常温常压下,1mol的氦气和氢气混合气,含有的核外电子数为2NA |
| C、25℃时,1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2 NA |
| D、标准状况下,2.24L CCl4和CH2O的混合物中含有NA个碳原子 |
下列说法中正确的是( )
| A、分子中键能越大,键长越长,则分子越稳定 |
| B、sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相近的新轨道 |
| C、PCl5分子中P原子和Cl原子最外层都满足8电子结构 |
| D、用价层电子互斥理论预测H2S和BF3的立体结构,分别为V形和平面正三角形 |
下列化学用语表达正确的是( )
| A、溴化钙的化学式是CaBr |
B、HCl分子的电子式 |
| C、乙烯的结构简式:CH2CH2 |
D、氯原子的结构示意图: |
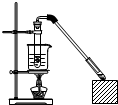 乙酸和乙醇反应的装置如图所示:在试管里加入3mL乙醇,然后一边摇动,一边慢慢地加入2mL浓硫酸和2mL冰醋酸,用酒精灯小心均匀地加热10min,将产生的蒸气经长导管通入到小试管中溶液的液面上.
乙酸和乙醇反应的装置如图所示:在试管里加入3mL乙醇,然后一边摇动,一边慢慢地加入2mL浓硫酸和2mL冰醋酸,用酒精灯小心均匀地加热10min,将产生的蒸气经长导管通入到小试管中溶液的液面上.