题目内容
海水中蕴藏着丰富的资源.海水综合利用的流程图如下.
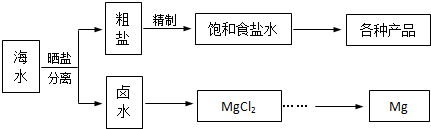
(1)粗盐中含Ca2+、Mg2+、Fe3+、SO42-及泥沙等杂质,需要提纯后才能综合利用.
粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤; ⑦蒸发.正确的操作顺序是 (填写序号字母).
A.⑤①③②④⑥⑦B.⑤①②③⑥④⑦C.⑤③①②⑥④⑦D.⑤③②①⑥④⑦
(2)NaCl做原料可以得到多种产品.
①工业上由金属钠制备过氧化钠的方法是:将金属钠迅速升温至熔化,并控制温度在300-400℃,通入经处理过的空气可制得过氧化钠,进行该处理的目的是 .工业生产中因温度过低而得不到纯净的过氧化钠,你认为可能含有的杂质是 (填化学式).
②实验室用惰性电极电解100mL0.1mol/LNaCl溶液,若阴阳两极均得到112mL气体(标准状况),则所得溶液的pH为 (忽略反应前后溶液的体积变化).
③电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式: .
(3)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品.
物质开始沉淀、沉淀完全需要的pH
①粗产品的溶液中含有Na+、Fe2+、Fe3+和Mn2+,需将Fe2+、Fe3+、Mn2+转化为沉淀除去.因此先向溶液中加入一种上述(2)中得到的物质NaClO,然后控制溶液的pH为 .
②在家用电热水器不锈钢内胆表面镶嵌镁棒,利用电化学原理来防止内胆腐蚀,写出正极的电极反应式: .

(1)粗盐中含Ca2+、Mg2+、Fe3+、SO42-及泥沙等杂质,需要提纯后才能综合利用.
粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤; ⑦蒸发.正确的操作顺序是
A.⑤①③②④⑥⑦B.⑤①②③⑥④⑦C.⑤③①②⑥④⑦D.⑤③②①⑥④⑦
(2)NaCl做原料可以得到多种产品.
①工业上由金属钠制备过氧化钠的方法是:将金属钠迅速升温至熔化,并控制温度在300-400℃,通入经处理过的空气可制得过氧化钠,进行该处理的目的是
②实验室用惰性电极电解100mL0.1mol/LNaCl溶液,若阴阳两极均得到112mL气体(标准状况),则所得溶液的pH为
③电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:
(3)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品.
物质开始沉淀、沉淀完全需要的pH
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 8.3 | 9.6 |
| 沉淀完成 | 3.7 | 9.6 | 9.5 | 11.1 |
②在家用电热水器不锈钢内胆表面镶嵌镁棒,利用电化学原理来防止内胆腐蚀,写出正极的电极反应式:
考点:海水资源及其综合利用,难溶电解质的溶解平衡及沉淀转化的本质,电解原理,物质的分离、提纯和除杂
专题:
分析:(1)把杂质转化为沉淀或气体除去,除钙离子用碳酸根离子,除镁离子用氢氧根离子,除Fe3+用氢氧根离子,除硫酸根离子用钡离子.要注意除杂质的顺序,后加的试剂最好能把前面先加的过量试剂除掉;
(2)①空气中的二氧化碳和水蒸气均能与过氧化钠反应,须先除去空气中的二氧化碳与水蒸气;钠和氧气缓慢氧化生成氧化钠;
②根据反应物、产物写出相应的电解方程式,根据方程式进行计算;
③由题意可知电解氯化钠溶液生成次氯酸钠和氢气;
(3)①从图中可看出将Fe2+、Fe3+、Mn2+转化为沉淀除去,PH最低应该为9.5,PH=10时Mg2+开始沉淀;
②金属发生电化学腐蚀,正极发生还原反应.
(2)①空气中的二氧化碳和水蒸气均能与过氧化钠反应,须先除去空气中的二氧化碳与水蒸气;钠和氧气缓慢氧化生成氧化钠;
②根据反应物、产物写出相应的电解方程式,根据方程式进行计算;
③由题意可知电解氯化钠溶液生成次氯酸钠和氢气;
(3)①从图中可看出将Fe2+、Fe3+、Mn2+转化为沉淀除去,PH最低应该为9.5,PH=10时Mg2+开始沉淀;
②金属发生电化学腐蚀,正极发生还原反应.
解答:
解:(1)去粗盐中的可溶性杂质:Mg2+、Ca2+、Fe3+、SO42-时,可以加入过量NaOH(去除镁离子和铁离子):Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓;
加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3,碳酸钠必须加在氯化钡之后,氢氧化钠和氯化钡可以颠倒加入的顺序;然后调节溶液的pH等于7后蒸发即可.所以顺序为⑤③②①⑥④⑦或⑤②③①⑥④⑦;
故答案为:D;
(2)①空气中的二氧化碳和水蒸气均能与过氧化钠反应,必须先除去空气中的二氧化碳与水蒸气,在通入到容器中和金属钠反应;钠在温度较低时可以和氧气缓慢氧化成氧化钠;
故答案为:防止过氧化钠与空气中的二氧化碳和水蒸汽反应;Na2O;
②因电解饱和食盐水的方程式:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,当产生的H2的体积为112mL即0.005mol时,生成氢氧化钠的物质的量为0.01mol,所以溶液中NaOH的物质的量浓度=
═0.1mol/L,所以氢离子的浓度为
=1×10-13mol/L,pH=13,
故答案为:13;
③③根据题意可知,氯气和氢氧化钠溶液反应生成物中只有一种溶质,所以该溶质是偏铝酸钠,则反应的化学方程式是NaCl+H2O
NaClO+H2↑,
故答案为:NaCl+H2O
NaClO+H2↑;
(3)①从图中可看出将Fe2+、Fe3+、Mn2+转化为沉淀除去,PH最低应该为9.5,PH=10.0时Mg2+开始沉淀,所以PH值最大应小于10.0,
故答案为:9.5≤PH<10.0;
②金属发生电化学腐蚀,正极发生还原反应,电极反应式为O2+4e-+2H2O═4OH-,故答案为:O2+4e-+2H2O═4OH-.
加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3,碳酸钠必须加在氯化钡之后,氢氧化钠和氯化钡可以颠倒加入的顺序;然后调节溶液的pH等于7后蒸发即可.所以顺序为⑤③②①⑥④⑦或⑤②③①⑥④⑦;
故答案为:D;
(2)①空气中的二氧化碳和水蒸气均能与过氧化钠反应,必须先除去空气中的二氧化碳与水蒸气,在通入到容器中和金属钠反应;钠在温度较低时可以和氧气缓慢氧化成氧化钠;
故答案为:防止过氧化钠与空气中的二氧化碳和水蒸汽反应;Na2O;
②因电解饱和食盐水的方程式:2NaCl+2H2O
| ||
| 0.01mol |
| 0.1L |
| 1×10-14 |
| 0.1 |
故答案为:13;
③③根据题意可知,氯气和氢氧化钠溶液反应生成物中只有一种溶质,所以该溶质是偏铝酸钠,则反应的化学方程式是NaCl+H2O
| ||
故答案为:NaCl+H2O
| ||
(3)①从图中可看出将Fe2+、Fe3+、Mn2+转化为沉淀除去,PH最低应该为9.5,PH=10.0时Mg2+开始沉淀,所以PH值最大应小于10.0,
故答案为:9.5≤PH<10.0;
②金属发生电化学腐蚀,正极发生还原反应,电极反应式为O2+4e-+2H2O═4OH-,故答案为:O2+4e-+2H2O═4OH-.
点评:本题考查较为综合,涉及物质分离提纯、电解等知识,题目综合度较高,要求学生具有分析和解决问题的能力,难度较大,注意试剂加入顺序和过量试剂的除去.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
将铜片投入到稀硫酸中,铜片不溶,加入下列试剂后,可使铜片溶解的是( )
| A、稀盐酸 | B、硫酸钠晶体 |
| C、硝酸钠晶体 | D、氯化铁晶体 |
下列关于物质的检验说法正确的是( )
| A、加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定有硫酸根离子 |
| B、钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧至无色,然后再用铂丝蘸取固体氯化钾,进行灼烧,直接观察火焰颜色 |
| C、加入NaOH溶液,加热,放出能使湿润的红色石蕊试纸变蓝的气体,证明一定含有NH4+ |
| D、加入AgNO3溶液,有白色沉淀生成,证明含有Cl- |
如图所示与对应的叙述相符的是( )


| A、甲图表示可逆反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2 (g)增大压强后,V正、V逆变化图 |
| B、乙图是标准状况下,某同学向100mL H2S饱和溶液中通入SO2,所得溶液pH变化图.由图可知ab段反应是:SO2+2H2S═3S↓+2H2O |
| C、丙图表明合成氨反应温度与转化率之间的关系,由图知合成氨反应是吸热反应 |
| D、丁图表明向一定量的NaOH溶液中逐滴加入AlCl3溶液的反应.说明反应分两步:①Al3++3OH-=Al(OH)3↓②Al(OH)3+OH-=AlO2-+2H2O |
下列关于有机物的叙述正确的是( )
| A、我国居民传统膳食以糖类为主,淀粉、脂肪都是糖类物质 |
| B、人体内的蛋白质不断分解,最终生成水和二氧化碳排出体外 |
| C、乙醇可以被氧化为乙酸,二者均能发生酯化反应 |
| D、用氢氧化钠溶液可除去乙酸乙酯中混有的少量的乙酸 |
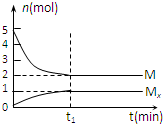 E是非金属性最强的元素,M是E的气态氢化物,在一定体积的密闭容器中,气体M存在如下关系:aM(g)?bMx(g ),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
E是非金属性最强的元素,M是E的气态氢化物,在一定体积的密闭容器中,气体M存在如下关系:aM(g)?bMx(g ),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )| A、该反应的化学方程式是2HF?(HF)2 |
| B、时刻,保持温度不变,再充入5molM,重新达到平衡时,将减小 |
| C、平衡时混合气体的平均摩尔质量是33.3g/mol |
| D、M的沸点比同主族下一周期元素的气态氢化物沸点低 |
 某同学在帮助老师整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶,由于腐蚀,其标签已破损(如图:标签上部的化学式和下部的名称都不完整),根据前几天做过的实验判断,它是中学化学中常见的溶液.
某同学在帮助老师整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶,由于腐蚀,其标签已破损(如图:标签上部的化学式和下部的名称都不完整),根据前几天做过的实验判断,它是中学化学中常见的溶液.