题目内容
海水是工业的资源宝藏.工业上海水资源综合开发利用的部分工艺流程如图所示.

(1)南海渔民通常在夏天晒盐利用了 原理,盐田一般分为 、 、 三部分.
(2)为了使结晶析出的晶体颗粒细小,采取下列哪些因素 较为有利
A.快速蒸发溶剂 B.溶液浓度较高 C.溶质溶解度较小 D.缓慢蒸发溶剂
(3)电解饱和食盐水常用离子膜电解槽和隔膜电解槽,离子膜和隔膜均允许通过的分子或离子是 .电解槽中的阳极材料为 .
(4)本工艺流程中先后制得Br2、CaSO4和Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4顺序制备? 原因是 .
(5)溴单质在四氯化碳中的溶解度比在水中大得多,四氯化碳与水不互溶,故可用于萃取溴,但在上述工艺中却不用四氯化碳,原因是 .
(6)从苦卤再提取溴要经过氧化、吹出、吸收、氧化、分馏等过程,其中吸收的目的是 ,有关的离子方程式为 .

(1)南海渔民通常在夏天晒盐利用了
(2)为了使结晶析出的晶体颗粒细小,采取下列哪些因素
A.快速蒸发溶剂 B.溶液浓度较高 C.溶质溶解度较小 D.缓慢蒸发溶剂
(3)电解饱和食盐水常用离子膜电解槽和隔膜电解槽,离子膜和隔膜均允许通过的分子或离子是
(4)本工艺流程中先后制得Br2、CaSO4和Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4顺序制备?
(5)溴单质在四氯化碳中的溶解度比在水中大得多,四氯化碳与水不互溶,故可用于萃取溴,但在上述工艺中却不用四氯化碳,原因是
(6)从苦卤再提取溴要经过氧化、吹出、吸收、氧化、分馏等过程,其中吸收的目的是
考点:海水资源及其综合利用
专题:实验设计题
分析:(1)根据溶解度受影响的大小,选择结晶的操作方法--蒸发结晶或降温结晶法;溶解度受温度影响不大的物质结晶时一般采取蒸发结晶的方法;海水中含有大量的氯化钠,工业上采取晒海水使水分蒸发,最后制得食盐的方法,根据蒸发结晶步骤分析盐田组成;
(2)NaCl溶解较小,根据溶质的溶解度越小,或溶液的浓度越大,或溶剂的蒸发速度越快,或溶液冷却得越快,析出的晶体颗粒就越小分析;
(3)根据电解饱和食盐水水时为了提高产率,通常将中间加入离子膜,只允许阳离子和水分子通过,电解饱和食盐水时阳极材料可以用钛(或石墨)做电极;
(4)硫酸钙属于微溶物,可以先使其沉淀下来,在沉淀镁离子,若先沉淀镁离子,则会有部分硫酸钙掺杂在氢氧化镁中,使固体不纯;
(5)四氯化碳萃取溴,有优点也有缺点,优点是溴单质在四氯化碳中的溶解度大,四氯化碳与水不互溶,缺点是四氯化碳萃取法工艺复杂、设备投资大;经济效益低、环境污染严重;
(6)通过海水蒸发得到淡水、NaCl、母液,向母液中通入氯气,发生反应Cl2+2Br-=2Cl-+Br2,利用热空气吹出溴,用SO2吸收Br2,发生反应SO2+Br2+2H2O=H2SO4+2HBr,向溶液中通入氯气发生反应Cl2+2Br-=2Cl-+Br2,然后采用萃取的方法获取Br2,其中吸收的目的是富聚溴.
(2)NaCl溶解较小,根据溶质的溶解度越小,或溶液的浓度越大,或溶剂的蒸发速度越快,或溶液冷却得越快,析出的晶体颗粒就越小分析;
(3)根据电解饱和食盐水水时为了提高产率,通常将中间加入离子膜,只允许阳离子和水分子通过,电解饱和食盐水时阳极材料可以用钛(或石墨)做电极;
(4)硫酸钙属于微溶物,可以先使其沉淀下来,在沉淀镁离子,若先沉淀镁离子,则会有部分硫酸钙掺杂在氢氧化镁中,使固体不纯;
(5)四氯化碳萃取溴,有优点也有缺点,优点是溴单质在四氯化碳中的溶解度大,四氯化碳与水不互溶,缺点是四氯化碳萃取法工艺复杂、设备投资大;经济效益低、环境污染严重;
(6)通过海水蒸发得到淡水、NaCl、母液,向母液中通入氯气,发生反应Cl2+2Br-=2Cl-+Br2,利用热空气吹出溴,用SO2吸收Br2,发生反应SO2+Br2+2H2O=H2SO4+2HBr,向溶液中通入氯气发生反应Cl2+2Br-=2Cl-+Br2,然后采用萃取的方法获取Br2,其中吸收的目的是富聚溴.
解答:
解:(1)“夏天晒盐”是因为食盐的溶解度受温度变化的影响不大,夏天气温高,水分蒸发快,食盐易结晶析出;海水制盐的过程主要是海水蒸发后出现结晶盐,工业上采取晒海水使水分蒸发,最后制得食盐,所以盐田一般分为储水池、蒸发池、结晶池三部分,
故答案为:“蒸发结晶;储水池;蒸发池;结晶池;
(2)晶体颗粒的大小与结晶条件有关,溶质的溶解度越小,或溶液的浓度越高,或溶剂的蒸发越快,或溶液冷却得越快,析出的晶粒就越细小,反之越大,
故答案为:ABC;
(3)电解饱和食盐水,电解槽离子膜或隔膜,允许阳离子(或Na+)和水分子通过,不允许阴离子通过;阳极生成氯气,阳极材料可以用钛(或石墨)做电极,
故答案为:阳离子(或Na+);钛(或石墨);
(4)工艺流程中先后制得Br2、CaSO4和Mg(OH)2,不能沉淀Mg(OH)2,硫酸钙为微溶物,如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,使产品不纯.
故答案为:否;如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,产品不纯;
(5)因为溴单质在四氯化碳中的溶解度比在水中大得多,而且四氯化碳与水不互溶,因此可用于萃取,但也有缺点,如四氯化碳萃取法工艺复杂、设备投资大;经济效益低、环境污染严重,
故答案为:四氯化碳萃取法工艺复杂、设备投资大,经济效益低、环境污染严重;
(6)海水中溴元素含量较少,步骤Cl2+2Br-=2Cl-+Br2中已获得Br2,步骤Br2+SO2+2H2O=4H++2Br-+SO42-中又将Br2还原为Br-,其目的为富集溴元素,
故答案为:富聚溴;Br2+SO2+2H2O=4H++2Br-+SO42-;
故答案为:“蒸发结晶;储水池;蒸发池;结晶池;
(2)晶体颗粒的大小与结晶条件有关,溶质的溶解度越小,或溶液的浓度越高,或溶剂的蒸发越快,或溶液冷却得越快,析出的晶粒就越细小,反之越大,
故答案为:ABC;
(3)电解饱和食盐水,电解槽离子膜或隔膜,允许阳离子(或Na+)和水分子通过,不允许阴离子通过;阳极生成氯气,阳极材料可以用钛(或石墨)做电极,
故答案为:阳离子(或Na+);钛(或石墨);
(4)工艺流程中先后制得Br2、CaSO4和Mg(OH)2,不能沉淀Mg(OH)2,硫酸钙为微溶物,如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,使产品不纯.
故答案为:否;如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,产品不纯;
(5)因为溴单质在四氯化碳中的溶解度比在水中大得多,而且四氯化碳与水不互溶,因此可用于萃取,但也有缺点,如四氯化碳萃取法工艺复杂、设备投资大;经济效益低、环境污染严重,
故答案为:四氯化碳萃取法工艺复杂、设备投资大,经济效益低、环境污染严重;
(6)海水中溴元素含量较少,步骤Cl2+2Br-=2Cl-+Br2中已获得Br2,步骤Br2+SO2+2H2O=4H++2Br-+SO42-中又将Br2还原为Br-,其目的为富集溴元素,
故答案为:富聚溴;Br2+SO2+2H2O=4H++2Br-+SO42-;
点评:本题考查了电解饱和食盐水的装置,海水提取物质的先后顺序,侧重于学生的分析能力、实验能力的考查,为高考常见题型,答题时注意把握相关物质的性质,题目难度中等.

练习册系列答案
相关题目
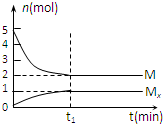 E是非金属性最强的元素,M是E的气态氢化物,在一定体积的密闭容器中,气体M存在如下关系:aM(g)?bMx(g ),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
E是非金属性最强的元素,M是E的气态氢化物,在一定体积的密闭容器中,气体M存在如下关系:aM(g)?bMx(g ),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )| A、该反应的化学方程式是2HF?(HF)2 |
| B、时刻,保持温度不变,再充入5molM,重新达到平衡时,将减小 |
| C、平衡时混合气体的平均摩尔质量是33.3g/mol |
| D、M的沸点比同主族下一周期元素的气态氢化物沸点低 |
甲、乙两溶液中,分别含有大量的Cu2+、K+、H+、Cl-、CO32-、OH-6种离子中的3种,已知甲溶液呈蓝色,则乙溶液中大量存在的离子是( )
| A、CO32-、OH-、Cl- |
| B、Cu2+、H+、Cl- |
| C、K+、H+、Cl- |
| D、K+、OH-、CO32- |
如图为阳离子交换膜法电解饱和食盐水原理示意图.下列说法不正确的是( )


| A、完全电解后加适量盐酸可以恢复到电解前的浓度 |
| B、从B中加入含少量NaOH的水溶液以增强导电性 |
| C、标准状况下每生成22.4 L Cl2,使产生2 mol NaOH |
| D、从E口逸出的气体是H2 |
设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A、0.1mol Fe 与0.1mol Cl2充分反应,转移的电子数为0.3 NA |
| B、常温常压下,1mol的氦气和氢气混合气,含有的核外电子数为2NA |
| C、25℃时,1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2 NA |
| D、标准状况下,2.24L CCl4和CH2O的混合物中含有NA个碳原子 |
 某同学在帮助老师整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶,由于腐蚀,其标签已破损(如图:标签上部的化学式和下部的名称都不完整),根据前几天做过的实验判断,它是中学化学中常见的溶液.
某同学在帮助老师整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶,由于腐蚀,其标签已破损(如图:标签上部的化学式和下部的名称都不完整),根据前几天做过的实验判断,它是中学化学中常见的溶液.