题目内容
1.下列叙述正确的是( )| A. | 非金属与金属化合形成离子化合物 | |
| B. | 含有共价键的化合物都是共价化合物 | |
| C. | 非极性键只存在于双原子单质分子里 | |
| D. | 共价化合物中一定存在极性共价键 |
分析 A.非金属与金属化合可能为共价化合物;
B.离子化合物中可存在共价键;
C.非极性键可存在于离子化合物、共价化合物中;
D.共价化合物至少含两种不同非金属元素.
解答 解:A.非金属与金属化合可能为共价化合物,如氯化铝为共价化合物,故A错误;
B.离子化合物中可存在共价键,如NaOH中含离子键和共价键,故B错误;
C.非极性键可存在于离子化合物、共价化合物中,如过氧化钠、过氧化氢均含O-O非极性键,故C错误;
D.共价化合物至少含两种不同非金属元素,则一定含极性共价键,故D正确;
故选D.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键及常见的实例,题目难度不大.

练习册系列答案
相关题目
11.An+、Bn-、C 3种短周期元素的粒子具有相同的电子层结构,则关于它们的叙述正确的是( )
| A. | 原子序数:C>B>A | B. | 离子半径:Bn-<An+ | ||
| C. | C是稀有气体元素的原子 | D. | 原子半径:A<B |
12.现有A、B、C、D四种金属片,
①把A、B用导线连接后同时浸入稀硫酸中,A上有气泡产生;
②把C、D用导线连接后同时浸入稀硫酸中,D发生还原反应;
③把A、C用导线连接后同时浸入稀硫酸中,电子流动方向为A→导线→C.
上述四种金属的活动性顺序为( )
①把A、B用导线连接后同时浸入稀硫酸中,A上有气泡产生;
②把C、D用导线连接后同时浸入稀硫酸中,D发生还原反应;
③把A、C用导线连接后同时浸入稀硫酸中,电子流动方向为A→导线→C.
上述四种金属的活动性顺序为( )
| A. | A>B>C>D | B. | C>A>B>D | C. | D>B>C>A | D. | B>A>C>D |
9.下列过程中,共价键被破坏的是( )
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水 ⑤冰融化⑥NH4Cl受热分解 ⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水.
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水 ⑤冰融化⑥NH4Cl受热分解 ⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水.
| A. | ①④⑥⑦ | B. | ④⑥⑧ | C. | ①②④⑤ | D. | ④⑥ |
6.将含有0.4molNaCl和0.4molCu(NO3)2的水溶液1L用惰性电极电解一段时间后,在一个电极上析出0.3molCu,此时在另一个电极上放出气体的体积(标准状况)约为( )
| A. | 6.72L | B. | 5.6L | C. | 2.8L | D. | 13.44L |
10.25℃,加水将10mL pH=11的氨水稀释至1L,则下列判断中正确的是( )
| A. | 稀释后溶液的pH=9 | |
| B. | 稀释过程中,溶液中所有离子的浓度均减小 | |
| C. | 稀释后溶液中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}.{H}_{2}O)}$减小 | |
| D. | 该氨水稀释前后中和盐酸的能力相同 |
11.下列有关实验的操作和结论正确的是( )
| A. | 明矾和漂白粉均可用于自来水的杀菌、消毒 | |
| B. | 用丁达尔实验可以将Al(OH)3胶体和NaCl溶液区分 | |
| C. | CCl4萃取碘水中的I2,先从分液漏斗下口放出有机层,后从分液漏斗下口放出水层 | |
| D. | 浓盐酸与MnO2反应制备纯净Cl2,气体产物先通过浓硫酸,后通过饱和食盐水 |
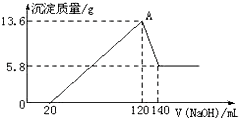 将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应.向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如图.回答下列问题:(不要求写出计算过程)
将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应.向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如图.回答下列问题:(不要求写出计算过程)