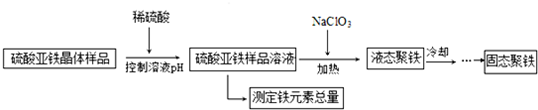
题目内容
12.下列说法正确的是( )| A. | 淀粉溶液与少量硫酸共热后,加NaOH溶液至碱性,再加碘水无明显现象,说明淀粉已水解完全 | |
| B. | 称取一定量已潮解的NaOH,配成一定体积溶液,取该溶液滴定未知浓度盐酸,则盐酸测定浓度偏高 | |
| C. | 电器设备所引起的火灾,可用二氧化碳或四氯化碳灭火器灭火,也可用泡沫灭火器灭火 | |
| D. | 往硫酸铝溶液中加入过量氨水,溶液先浑浊后澄清,说明氢氧化铝具有两性 |
分析 A.碘能够与氢氧化钠反应;
B.中和滴定不当操作导致消耗标准液偏大,则所测结果偏高;
C.电器设备引起的火灾,应先关闭电源;
D.硫酸铝与氨水反应生成氢氧化铝和硫酸铵.
解答 解:A.淀粉溶液与少量硫酸共热后,加NaOH溶液至碱性,再加碘水无明显现象,因为碘能够与氢氧化钠反应,所以即使淀粉没有完全水解,也不会有明显现象,故A错误;
B.称取一定量已潮解的NaOH,配成一定体积溶液,依据C=$\frac{n}{V}$可知,溶质氢氧化钠偏小,则所配标准溶液浓度偏低,用来滴定盐酸,消耗标准液体积偏大,导致盐酸浓度偏高,故B正确;
C.泡沫灭火器灭火时喷出的泡沫中含有水分,容易在电器短路灭火时导致触电及损坏电器,所以不可用泡沫灭火器灭火,故C错误;
D.硫酸铝与氨水反应生成氢氧化铝和硫酸铵,氢氧化铝不溶于弱碱,所以不会产生溶液先浑浊后澄清现象,故D错误;
故选:B.
点评 本题考查了淀粉的性质、一定物质的量浓度溶液配制、中和滴定误差分析,泡沫灭火器原理,铝盐的性质,侧重考查学生对基础知识掌握熟练程度,题目难度不大.

练习册系列答案
相关题目
2.对乙烯基苯甲酸在医药中间体合成中有着广泛的用途,可用化合物M反应合成:
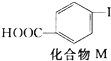 +CH2═CH2$\stackrel{一定条件}{→}$
+CH2═CH2$\stackrel{一定条件}{→}$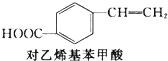 +HI
+HI
下列关于化合物M和对乙烯基苯甲酸的说法正确的是( )
 +CH2═CH2$\stackrel{一定条件}{→}$
+CH2═CH2$\stackrel{一定条件}{→}$ +HI
+HI下列关于化合物M和对乙烯基苯甲酸的说法正确的是( )
| A. | 对乙烯基苯甲酸的分子式为C9H10O2 | |
| B. | 对乙烯基苯甲酸的同分异构体共有三种 | |
| C. | 对乙烯基苯甲酸既属于羧酸,又属于烯烃 | |
| D. | 二者均可发生取代反应和加成反应 |
3.某溶液中可能含有K+、Ba2+、NH4+、S2-、I-、SO42-,分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象.为确定该溶液的组成,还需检验的离子是( )
| A. | K+ | B. | NH4+ | C. | SO42- | D. | S2- |
20.根据下列实验操作和观察到的现象,得出的结论一定是正确的是( )
| 实验操作 | 现象 | 结论 | |
| A | SO2通入溴水中 | 溴水褪色 | SO2具有漂白性 |
| B | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | 溶液变成黄色 | 氧化性:H2O2>Fe2+ |
| C | 将溴乙烷与NaOH的乙醇溶液共热,将生成的气体直接通入KMnO4酸性溶液中 | KMnO4酸性溶液褪色 | 乙烯使KMnO4酸性溶液褪色 |
| D | 向a、b两支盛有KI3溶液的试管中分别加入淀粉溶液、硝酸银溶液. | a试管中溶液变蓝 b试管中产生黄色沉淀 | KI3溶液中存在平衡I3--?I2+I- |
| A. | A | B. | B | C. | C | D. | D |
7.某无色溶液中可能含有Na+、K+、NH4+、Mg2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol•L-1.往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成.某同学另取少量原溶液,设计并完成如下实验:则关于原溶液的判断中正确的是( )
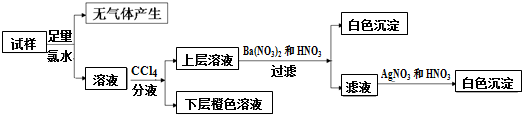

| A. | 若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响 | |
| B. | 无法确定原溶液中是否存在Cl- | |
| C. | 肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定 | |
| D. | 肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证 |
17.下列仪器的使用、实验药品选择或实验现象描述正确的是( )
| A. | 物质的分离提纯方法之一为“筛分”,如:胶体--渗析法提纯,浊液--过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的“筛子” | |
| B. | 容量瓶、量筒和滴定管上都标有使用温度,容量瓶无“0”刻度,量筒和滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| C. | 工业上电解饱和食盐水时,为了阻止产物相互之间反应,往往用阴离子交换膜把阳极和阴极隔开 | |
| D. | 室温下,浓度均为0.1 mol•L-1Na2S2O3和H2SO4溶液,各取5 mL、10 mL的Na2S2O3溶液分别与10 mL的H2SO4溶液混合反应,可验证Na2S2O3浓度对反应速率的影响 |
4.下列有关说法正确的是( )
| A. | 分离Fe2O3、Al2O3操作依次为溶解、过滤、灼烧 | |
| B. | 粗盐可通过溶解、过滤、蒸发、结晶的方法提纯 | |
| C. | 配制氯化铁溶液,是将FeCl3溶于蒸馏水,再加入一定量的铁粉 | |
| D. | 取用金属钠或钾时,没用完的钠或钾要放回原瓶 |
1.下列指定反应的离子方程式正确的是( )
| A. | 氨水溶解氯化银沉淀:AgCl+2NH3•H2O=[Ag(NH3)2]++Cl-+2H2O | |
| B. | CH3COOH溶液除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 酸性K2Cr2O7溶液氧化双氧水:Cr2O72-+8H++5H2O2=2 Cr3++4O2↑+9H2O | |
| D. | 将NaHSO4与Ba(OH)2溶液混合至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |