题目内容
1.下列指定反应的离子方程式正确的是( )| A. | 氨水溶解氯化银沉淀:AgCl+2NH3•H2O=[Ag(NH3)2]++Cl-+2H2O | |
| B. | CH3COOH溶液除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 酸性K2Cr2O7溶液氧化双氧水:Cr2O72-+8H++5H2O2=2 Cr3++4O2↑+9H2O | |
| D. | 将NaHSO4与Ba(OH)2溶液混合至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
分析 A.氨水与氯化银沉淀发生络合反应生成可溶性络合物;
B.醋酸为弱酸,应保留化学式;
C.得失电子不守恒;
D.将NaHSO4与Ba(OH)2溶液混合至中性,硫酸氢钠与氢氧化钡物质的量之比为2:1;
解答 解:A.氨水与氯化银沉淀发生络合反应生成可溶性络合物,离子方程式:AgCl+2NH3•H2O=[Ag(NH3)2]++Cl-+2H2O,故A正确;
B.CH3COOH溶液除去水垢中的CaCO3,离子方程式:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故B错误;
C.酸性K2Cr2O7溶液可氧化双氧水H2O2的离子反应为Cr2O72-+8H++3H2O2=2Cr3++3O2↑+7H2O,故C错误;
D.将NaHSO4与Ba(OH)2溶液混合至中性,离子方程式:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D错误;
故选:A.
点评 本题考查了离子方程式书写,侧重考查复分解反应、氧化还原反应的离子方程式,明确反应实质是解题关键,注意化学式的拆分、注意离子反应遵循得失电子守恒规律,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.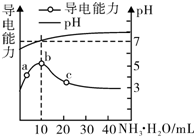 常温下,向10mL 0.1mol/L的HR溶液中逐滴滴入0.l mol/L的氨水,溶液pH及导电性变化如图.下列分析正确的是( )
常温下,向10mL 0.1mol/L的HR溶液中逐滴滴入0.l mol/L的氨水,溶液pH及导电性变化如图.下列分析正确的是( )
 常温下,向10mL 0.1mol/L的HR溶液中逐滴滴入0.l mol/L的氨水,溶液pH及导电性变化如图.下列分析正确的是( )
常温下,向10mL 0.1mol/L的HR溶液中逐滴滴入0.l mol/L的氨水,溶液pH及导电性变化如图.下列分析正确的是( )| A. | HR为强酸 | |
| B. | 加入10 mL 氨水时,溶液中c(NH4+)>c(R-) | |
| C. | c点溶液存在c(NH4+)<c( R-) | |
| D. | b点的离子浓度大于a点的离子浓度 |
12.下列说法正确的是( )
| A. | 淀粉溶液与少量硫酸共热后,加NaOH溶液至碱性,再加碘水无明显现象,说明淀粉已水解完全 | |
| B. | 称取一定量已潮解的NaOH,配成一定体积溶液,取该溶液滴定未知浓度盐酸,则盐酸测定浓度偏高 | |
| C. | 电器设备所引起的火灾,可用二氧化碳或四氯化碳灭火器灭火,也可用泡沫灭火器灭火 | |
| D. | 往硫酸铝溶液中加入过量氨水,溶液先浑浊后澄清,说明氢氧化铝具有两性 |
16.工业上常利用铝粉和氧化铁反应来焊接铁轨.下列说法正确的是( )
| A. | 氧化铝、氧化铁均为两性氧化物 | |
| B. | 氧化铝中的微粒半径:r(Al3+)>r(O2-) | |
| C. | 在该反应中,铝的还原性强于铁的还原性 | |
| D. | 1mol 氧化铁参加反应转移电子数约为4×6.02×1023 |
10.下列反应过程中能引入卤素原子的是( )
①消去反应②取代反应③加成反应④水解反应.
①消去反应②取代反应③加成反应④水解反应.
| A. | ①② | B. | ①②③ | C. | ②③ | D. | ①②③④ |
20.NA为阿伏加德罗常数的値,下列说法中正确的是( )
| A. | 3.2gO2、O3组成的混合物中含有的质子数为1.6NA | |
| B. | 当反应6HCl+KClO3═Cl2↑+KC1+3H2O有71gC l2生成时,转移电子数目为2NA | |
| C. | 1molC2H4分子中含共用电子对的数自为5NA | |
| D. | 0.1mol乙醇与足量乙酸充分反应后,生成的水分子数目为0.1NA |
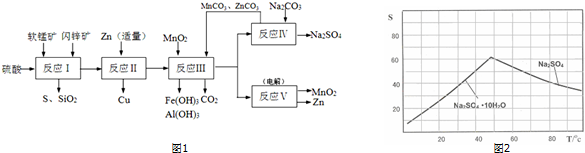

 ;由C→D的反应类型是取代反应.
;由C→D的反应类型是取代反应. .
. )的合成路线流程(无机试剂可任选).合成路线流程图示例如下:
)的合成路线流程(无机试剂可任选).合成路线流程图示例如下: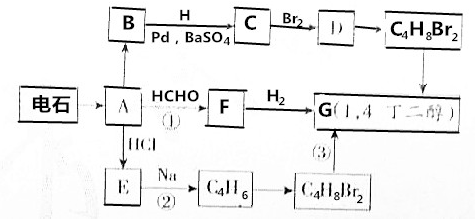
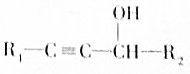 (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)